Уксусная кислота лимонная кислота: СХОДСТВО И РАЗЛИЧИЕ УКСУСНОЙ КИСЛОТЫ И ЛИМОННОЙ
Метаболизм органических кислот дрожжами при брожении
- виноделие
- брожение
- вещества
Содержание материала
- Метаболизм органических кислот дрожжами при брожении
- Роль органических кислот при технологии и выдержке вина
Страница 1 из 2
Глава 13
МЕТАБОЛИЗМ ОРГАНИЧЕСКИХ КИСЛОТ ДРОЖЖАМИ ПРИ БРОЖЕНИИ
Органические кислоты являются продуктами диссимиляции углеводов, аминокислот и жиров микроорганизмами. Существуют два пути превращения углеводов: аэробнопентозофосфатный и анаэробно-гликолитический.
В результате углеводного и азотистого обмена у дрожжей в процессе алкогольного брожения образуется целый ряд веществ, играющих важную роль в формировании вина. Среди этих веществ на одном из первых мест стоят органические кислоты, которые играют определенную физиологическую роль, в значительной степени определяют внутренние условия среды (pH) в дрожжевой клетке и регулируют внутреннюю интенсивность и направленность биохимических реакций.
В зависимости от соотношения свободных и связанных в соли кислот находится актуальная кислотность и концентрация водородных ионов.
Основные представления о путях превращений органических кислот в растениях и микроорганизмах изложены в работах
С. П. Костычева, В. С. Бутуевича, М. В. Федорова, Т. Кшонца, К. Бергауэра, X. Кребса и В. Джонсона, X. Корберга и X. Кребса, Д. Девиса и др.
С. П. Костычев [53] на заре развития биохимии считал, что образование лимонной кислоты немыслимо без синтетических реакций. Впоследствии это было подтверждено советскими и зарубежными исследователями.
Позднее было доказано, что синтез лимонной кислоты протекает по циклу Кребса посредством конденсации щавелевоуксусной кислоты с ацетил-КоА. Был выделен фермент, который катализировал конденсацию щавелевоуксусной кислоты с ацетил- КоА, поэтому этот фермент был назван конденсирующим энзимом.

.Изучение анаэробного распада углеводов привело к установлению следующих промежуточных продуктов: углеводы + фосфорная кислота + гексозофосфат → триозофосфат + фосфоглицериновая кислота → фосфопировиноградная кислота. Дальнейшее превращение пировнноградной кислоты в зависимости от наличия ферментативных систем у дрожжей протекает различно.
Известно, что пировиноградная кислота является исходным продуктом для синтеза целого ряда важнейших веществ, определяющих направление обмена в живой клетке.
Дрожжи способны декарбоксилировать пировиноградную кислоту в уксусный альдегид, они также способны непосредственно превращать пировиноградную кислоту в уксусную посредством окислительного декарбоксилирования.

Пировиноградная кислота участвует в синтезе кислот по циклу Кребса. Но прежде, чем она будет вовлечена в циклы ди- и трикарбоксильных кислот, она должна, с одной стороны, карбоксилироваться в щавелевоуксусную кислоту, а с другой — в присутствии коэнзима А превратиться в ацетил-КоА. Эти две реакции можно представить в следующем виде:
Коэнзим А является переносчиком ацетильной группы, которая присоединяется к нему через эфирную микроэргическую связь. Поэтому в микроорганизмах широко распространены ацетилфосфаты, которые принимают участие в биохимических реакциях, связанных с выделением энергии. Роль коэнзима А в биологических окислениях и синтезах стала более интенсивно исследоваться после препаративного приготовления его, осуществленного Ф. Линеном и Е. Рейхертом. Была установлена взаимная связь между изменением содержания коэнзима А в дрожжевых клетках и скоростью окисления уксусной кислоты. Доказано, что при недостатке коэнзима А дрожжи слабо окисляют уксусную кислоту.

Ацетил-КоА образуется не только из пировиноградной кислоты, но и из уксусной кислоты и уксусного альдегида. Источником образования щавелевоуксусной кислоты являются яблочная и аспарагиновая кислоты, а также путь карбоксилирования пировиноградной кислоты.
Дрожжи обладают всеми ферментативными системами для образования щавелевоуксусной кислоты из указанных соединений, они содержат также коэнзим А и способны образовывать ацетил- КоА из пировиноградной и уксусной кислот.
Методом бумажной хроматографии из культуральной жидкости дрожжей были выделены радиоактивная лимонная кислота, молочная, яблочная и янтарная.
Винные дрожжи способны превращать лимонную кислоту по циклу трикарбоксильных кислот и образовывать янтарную и глиоксалевую кислоты, последняя конденсируется с ацетил-КоА и образует яблочную кислоту по глиоксалатному циклу.

Кроме того, винные дрожжи также способны синтезировать лимонную кислоту из глютаминовой кислоты и аланина путем дезаминирования их в соответствующие кетокислоты и в дальнейшем превращать их по циклу Кребса.
Во-первых, винные дрожжи способны карбоксилировать пиро- виноградную кислоту в щавелевоуксусную. Они также способны превращать пировиноградную кислоту в ацетил-КоА. Последний конденсируется с щавелевоуксусной кислотой и образует лимонную кислоту.
Во-вторых, дрожжи путем окислительного декарбоксилирования превращают пировиноградную кислоту в уксусную. Последнюю они способны конденсировать в янтарную кислоту через ацетил-КоА, янтарную кислоту они превращают в щавелевоуксусную через фумаровую и яблочную. Щавелевоуксусная кислота конденсируется с ацетил-КоА и образуется лимонная кислота.
В работе С. В. Дурмишидзе (1965) было показано, что меченая уксусная кислота превращается в янтарную, фумаровую и гликолевую кислоты. По данным автора процесс ассимиляции и превращения уксусной кислоты протекает на всех стадиях алкогольного брожения.

Генезис уксусной кислоты при алкогольном брожении долгое время оставался неясным и только благодаря работам С. П. Костычева стало известно, что дрожжи превращают уксусный альдегид и в этанол и уксусную кислоту по следующей схеме:
По современным представлениям эта реакция протекает в два этапа: на первом уксусный альдегид присоединяет кислород воды и окисляется до уксусной кислоты, при этом водород воды восстанавливает НАД, который участвует в этой реакции: СН3СНO+Н2O+НАД→СН3СOOН+НАД.h3.
Образовавшийся НАД-Н2 восстанавливает вторую молекулу уксусного альдегида в спирт: СН3СНО+НАД-Н2→СН3—СН2ОН.
Исследования Е. Пейно показали, что в начале брожения количество летучих кислот, в частности уксусной, заметно возрастает, затем процесс замедляется, количество летучих кислот стабилизируется и в конце брожения начинает убывать. Этот автор считает, что в период интенсивного размножения дрожжей их восстановительная способность высока, поэтому и происходит восстановление уксусной кислоты в этанол.

Известно, что при усилении восстановительных процессов происходит максимальное накопление этанола. Однако трудно понять непосредственное восстановление уксусной кислоты в этиловый спирт, как это понимает Е. Пейно.
Е. Пейно использовал способность дрожжей восстанавливать уксусную кислоту в этанол в анаэробных условиях для исправления вин с высоким содержанием уксусной кислоты/ как это было сделано Η. Ф. Саенко для лечения больных вин хересными дрожжами.
Образование уксусной кислоты в процессе спиртового брожения сусла зависит от pH среды и от температуры брожения. При брожении в менее кислой среде (pH 6) вначале образуется значительное количество уксусной кислоты, затем скорость образования уменьшается. При pH 7,5 она образуется равномерно в течение всего периода, а при pH 2,5 она в вине не накапливается.

Г. Г. Валуйко также наблюдал, что в присутствии кислорода летучих кислот образуется меньше. Известно, что аэробиоз подавляет образование летучих кислот. Объясняется это тем, что при сбраживании сусла в аэробных условиях уксусная кислота окисляется в ацетил-КоА через цикл Кребса.
В основном уксусная кислота образуется не только в процессе брожения, но и при ферментативном окислении спирта. Это происходит при выдержке виноматериалов с дрожжевым осадком. Процесс усиливается при аэробных условиях, т. е. если бочки не доливать вином до шпунта.
Уксусная кислота образуется также при β-окислении высокомолекулярных жирных кислот. При этом окисление происходит у того углеродного атома, который находится в β-положении по отношению к карбоксильной группе:
В результате разрыва цепочки жирной кислоты между а- и β-углеродными атомами образуется уксусная кислота; новая высокомолекулярная кислота будет содержать на 2 атома углерода меньше, чем исходная жирная кислота.
Известно, что при более высоком pH среды образуется меньше 2,3-бутиленгликоля и ацетоина и значительно больше — глицерина, летучих кислот и янтарной кислоты.
 Процесс образования янтарной кислоты очень сложный. Превращения улусной кислоты начинаются с образованием ацетил-КоА. Конденсируются не две молекулы уксусной кислоты, а активные ацетильные группы в виде ацетил-КоА, которые и образуют янтарную кислоту.
Процесс образования янтарной кислоты очень сложный. Превращения улусной кислоты начинаются с образованием ацетил-КоА. Конденсируются не две молекулы уксусной кислоты, а активные ацетильные группы в виде ацетил-КоА, которые и образуют янтарную кислоту.Янтарная кислота образуется также при расщеплении изолимонной кислоты при действии изоцитратазы по схеме:
Глиоксалевая кислота, согласно глиоксалатному циклу, вступает в реакцию с ацетил-КоА и образует яблочную кислоту по схеме
Эти три кислоты были найдены в винограде и вине.
В вине была обнаружена α-метиляблочная кислота, или лимонно-яблочная. Она образуется в результате конденсации пировнноградной кислоты с ацетил-КоА (Ж. Карл, 1969):
Существует и другой путь образования α-метиляблочной кислоты — это конденсация глиоксалевой кислоты с пропионилом- КоА с образованием α-оксиглутаровой кислоты. Последняя в результате внутримолекулярной перегруппировки превращается в метил яблочную кислоту по следующей схеме:
Последняя в результате внутримолекулярной перегруппировки превращается в метил яблочную кислоту по следующей схеме:
α-Оксиглутаровая кислота легко распадается на а-метиляблочную кислоту, а последняя — на пировиноградную и уксусную кислоты:
α-Метиляблочная кислота образуется также при декарбоксилировании лимонной кислоты винными дрожжами по схеме
Исследования показали, что α-метиляблочная кислота не содержится в винограде. Она образуется при алкогольном брожении из сахара в количестве от 70 до 180 мг/л. Концентрация ее прямо пропорциональна содержанию спирта и зависит от условий брожения, в частности от метаболитической активности дрожжей.
Количество α-метиляблочной кислоты зависит также и от pH среды: при pH 3,9 ее накапливается до 80, а при pH 3,2 до 282 мг/л. Количество α-метиляблочной кислоты в белых винах
колеблется от 65 до 147 мг/л и в красных — от 91 до 187 мг/л. Содержание ее значительно увеличивается при выдержке вина.
В вине найдены 2,3-диоксивалериановая, диметилглицериновая, или 2-метил-2,3-диоксимасляная кислоты. Последняя образуется в результате конденсации пировнноградной кислоты с уксусным альдегидом:
Последняя образуется в результате конденсации пировнноградной кислоты с уксусным альдегидом:
Образованная ацетомолочная кислота восстанавливается в присутствии НАД-Н2 в 2-метил-2,3-диоксимасляную кислоту.
Установлено, что содержание α-метиляблочной, диметилглицериновой и 2-метил-2,3-диоксимасляной кислот зависит от расы дрожжей и их метаболитической активности. Накопление двух последних кислот в винах зависит также от условий проведения брожения. Так при анаэробиозе количество их уменьшается.
В винах были найдены гликолевая, глиоксалевая, фумаровая, пировиноградная, щавелевоуксусная, глюконовая, галактуроновая кислоты. Что касается глюкуроновой кислоты, то, по мнению одних авторов, в обычных винах ее нет. Она встречается в винах, приготовленных из винограда, пораженного грибом Ботритис цинерея, при этом количество ее достигает 1 г/л и больше. Она образуется в результате окисления глюкозы ферментами этого гриба. По мнению других, глюкуроновая кислота встречается в бордоских сухих винах в количестве 100—200 мг/л.
В выдержанных винах содержится диоксифумаровая кислота. В аэробных условиях она быстро распадается на мезоксалевую, глиоксалевую, гликолевую и щавелевую кислоты.
Согласно данным П. Риберо-Гайона, содержание ароматических кислот (n-оксикоричной, n-оксибензойной и салициловой) в красных винах составляет от 50 до 100, а в белых — до 5 мг/л [154].
По данным этого же автора, в винах встречаются следующие фенольные кислоты: шикимовая, хинная, ферулевая, галловая, кофейная и протокатеховая. Биосинтез фенольных соединений был показан ранее.
В наибольшем количестве в винах встречаются жирные кислоты. Они находятся в свободном состоянии, в виде сложных эфиров, а также в виде солей. Низшие жирные кислоты (от С1 до С9) при обычных условиях являются жидкими. Обычно, начиная с масляной кислоты до С9, они представляют собой маслянистые жидкости и легко растворяются в воде в определенных концентрациях. Высшие жирные кислоты (от С10 и выше) являются твердыми веществами.
Дрожжевая клетка содержит все ферменты, катализирующие синтез и распад жирных кислот. Основными жирными кислотами вина являются уксусная, н-капроновая1, н-каприловая, н-каприновая и дециловая. В меньшем количестве встречаются муравьиная, пропионовая, изомасляная, α-метилмасляная, 2-метилдиоксимасляная, изовалериановая, 2-оксикапроновая и н-пеларгоновая.
Основными жирными кислотами вина являются уксусная, н-капроновая1, н-каприловая, н-каприновая и дециловая. В меньшем количестве встречаются муравьиная, пропионовая, изомасляная, α-метилмасляная, 2-метилдиоксимасляная, изовалериановая, 2-оксикапроновая и н-пеларгоновая.
Из высокомолекулярных кислот в винах содержатся лауриновая, пальмитиновая, стеариновая, олеиновая, линолевая и др.
- Вперед
- Назад
- Вперед
- Вы здесь:
- Главная
- Статьи org/ListItem»> Книги
- Основы биохимии виноделия
- Метаболизм органических кислот дрожжами при брожении
Еще почитать:
- Бактериальное брожение
- Влияние дрожжей на образование букетобразующих веществ
- Превращение фенольных соединений
- Обмен азотистых веществ при брожении
- Брожение виноградного сусла
Популярные метки: агротехника, болезни, вредители, вино, дегустация, здоровье, исследования, мороз, формировка, обрезка, зеленые операции, определить, питание, почва, полив, посадка, размножение, прививка, саженцы, продукция, созревание, селекция, сорта, техника и инструмент.
Поиск и метки, Контакты, Форум-виноград, Товары по виноградарству.
© Перепечатка и цитирование — только с активной гиперссылкой на сайт о винограде, в бумажных изданиях — только после согласования.
Биотехнологии в производстве органических кислот
Представлена группа органических кислот. Рассмотрена лимонная кислота, ее характеристики, сферы применения, рыночные показатели, технология производства.
Все мы переживаем сейчас непростое время. Мировой карантин стал катализатором давно назревавшего экономического кризиса. Многие отрасли находятся в критическом состоянии. Несмотря на снятие карантинных ограничений в ряде стран, существует значительная неопределенность по общим срокам выхода из кризиса. Хотя большинство экспертов склоняются к мнению, что начала подъема мировой экономики стоит ожидать в конце этого года. Скорее всего, это так и будет, а значит сейчас самое время для разработки бизнес-стратегий на ближайшие 7-10 лет.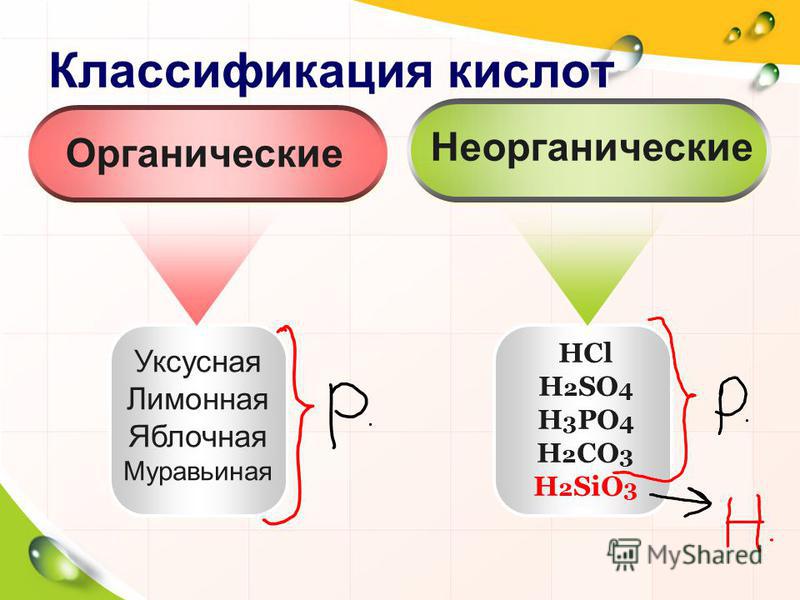 Начальный период подъема мировой экономики, после очередного экономического кризиса, располагает рядом благоприятных обстоятельств для старта масштабных проектов, к которым относятся и проекты глубокой переработки зерновых.
Начальный период подъема мировой экономики, после очередного экономического кризиса, располагает рядом благоприятных обстоятельств для старта масштабных проектов, к которым относятся и проекты глубокой переработки зерновых.
Я бы назвал сегодняшний период временем концептов.
Именно сейчас у бизнеса имеется хорошая возможность для разработки концепции будущего проекта, чтобы через полгода/год не терять время и дать старт его реализации.
В данном контексте, безусловно, большой интерес представляет возможность организации производства одной из органических кислот.
Органические кислоты – это органические вещества, проявляющие кислотные свойства. Самыми известными органическими кислотами являются уксусная, лимонная, молочная, аскорбиновая, муравьиная, щавелевая.
В последние годы благодаря достижениям в области технологии ферментации стало возможно производить значительное количество органических кислот из продукции сельского хозяйства. Для этого используются адаптированные микроорганизмы, которые преобразуют углеводы природного происхождения в органические кислоты.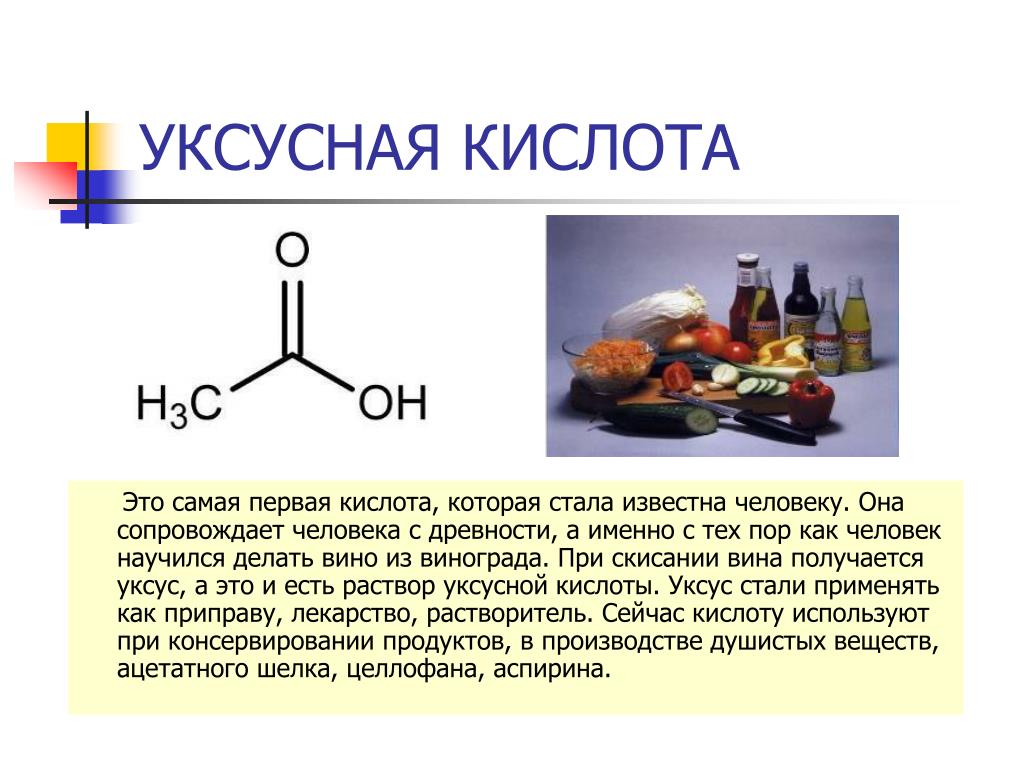 В качестве источника углеводов могут служить глюкоза, сахароза, спирт, производимые из зерновых и других агрокультур.
В качестве источника углеводов могут служить глюкоза, сахароза, спирт, производимые из зерновых и других агрокультур.
Благодаря своим органолептическим, физиологическим и химическим свойствам органические кислоты находят широкое применение в различных отраслях промышленности. Одним из ключевых потребителей является пищевая промышленность. Органические кислоты в качестве добавок широко используются в производстве пищевых и питьевых продуктов. На эти цели направляется более 45% производимых в мире органических кислот. Наибольшее применение имеют уксусная и лимонная кислоты, благодаря их антибактериальным и противогрибковым свойствам. В хлебобулочной и кондитерской промышленности уксусная и лимонная кислоты используются для предотвращения роста грибков и бактерий. Помимо их использования для антибактериальных и противогрибковых свойств, органические кислоты также применяются для регулирования кислотности, используются в качестве консервантов, антиоксидантов и усилителей вкуса в пищевых продуктах.
Читать по теме: Глубокая переработка зерна: от сырьевой экономики до высокомаржинальной продукции
Второй по значимости сферой применения является фармацевтическая промышленность благодаря использованию органических кислот в различных лекарствах, например, таких как аспирин и фенацетин. Кроме того, органические кислоты используются при производстве моющих средств, косметики, предметов личной гигиены, биопластика, кормов для животных и многих других товаров.
К примеру, муравьиная кислота находит применение в противогололедных веществах, в нефтедобыче, дублении кожи. Молочная кислота широко используется и имеет большие перспективы в производстве разлагаемых биопластиков.
Рост населения планеты в сочетании с ростом ВВП обеспечивают постоянно растущий спрос на органические кислоты. Согласно исследованиям, ожидается, что мировой рынок органических кислот будет демонстрировать устойчивый среднегодовой рост на уровне 5% в течение долгосрочного периода. Дополнительными факторами роста применения органических кислот, произведенных из натурального сырья посредством биотехнологий, являются возрастающие экологические требования к производству и повышенный запрос потребителей на продукты, состоящие из натуральных растительных ингредиентов.
Дополнительными факторами роста применения органических кислот, произведенных из натурального сырья посредством биотехнологий, являются возрастающие экологические требования к производству и повышенный запрос потребителей на продукты, состоящие из натуральных растительных ингредиентов.
Одним из таких ингредиентов является лимонная кислота – продукт, для производства которого используется самое распространенное в Украине сырье – пшеница и кукуруза.
Кроме уже знакомого нам применения лимонной кислоты в пищевой промышленности в качестве консерванта, антиоксиданта и усилителя вкуса, лимонная кислота применяется в фармацевтике при производстве лекарств.
В последние годы увеличивается использование лимонной кислоты в моющих средствах, так как благодаря способности кислоты к биологическому разложению она является идеальным заменителем фосфата. В связи с мировыми тенденциями решения проблем окружающей среды прогнозируется увеличение применения лимонной кислоты в производстве бытовых и промышленных химикатов.
В целом, для рынка лимонной кислоты многие годы были характерны стабильные уровни ежегодного роста потребления в 5-7%. Согласно прогнозам, к 2026 году рынок лимонной кислоты составит около 4,5 млрд. долл. США со среднеежегодным ростом в 4,6%. По мнению аналитиков, данная тенденция сохранится в долгосрочной перспективе.
Предполагается, что Азиатско-Тихоокеанский регион будет доминировать и в среднем рост потребления здесь составит 5,7% на период до 2026 года и далее. Весомую лепту внесут страны Ближнего Востока, где быстрыми темпами растет потребление фармацевтических препаратов и продуктов питания на основе лимонной кислоты. Высокие темпы роста останутся также в Северной Америке и Европе. При этом Западная Европа останется крупнейшим потребителем лимонной кислоты в мире.
Представляется интересным вариант производства лимонной кислоты в Украине с поставкой в Европу, тем более, что таможенные пошлины при поставках в страны ЕС будут равны нулю с 1921 года.
Основной диапазон цен на лимонную кислоту – 900-1300 евро/т.
У нас есть все основания полагать, что при правильной организации производства и стратегии сбыта продукции завод лимонной кислоты в Украине успешно сможет экспортировать свою продукцию.
В число ключевых игроков на мировом рынке лимонной кислоты входят Archer Daniels Midland Company, Shandong Juxian Hongde Citric Acid Co., Jungbunzlauer Suisse AG, Базель, Delek Group, Cargill, Incorporated, Weifang Ensign Industry Ltd.
В приложении к публикации представлена блок-схема процесса производства лимонной кислоты.
Блок-схема процесса производства лимонной кислоты
При ферментативном способе производства лимонной кислоты можно использовать широкую сырьевую базу. Весь спектр доступного сырья включает в себя сахаросодержащие культуры, такие как сахарная свекла или сахарный тростник. Также могут быть использованы крахмалы зерновых культур и корнеплодов, таких как кукуруза, пшеница и картофель.
Напомним, что из одной тонны кукурузы (содержание крахмала 61%) можно получить 460 кг лимонной кислоты, а из одной тонны пшеницы (содержание крахмала 58%) – 320 кг.
Для определения пригодности сырья к производству на начальном этапе проектирования необходимо проводить лабораторные испытания с целью определения его применимости к процессу ферментации. Крахмало- или сахаросодержащие природные источники требуют различных стратегий и процессов для биотехнологической обработки.
Читать по теме: Промышленные биотехнологии – основа глубокой переработки зерновых
Размножение спор
Ключевым условием для эффективного микробиологического процесса и функционирования предприятия в целом является наличие посевного материала. В случае синтеза лимонной кислоты посевной материал добавляется в бродильный чан в виде спор от производственного штамма в начале процесса. Поэтому принципиально важно иметь технологию разведения спор и их тестирования для обеспечения высокого качество этого материала. Для повышения возможности хранения, а также упрощения дозации желательно споры высушивать.
Обработка сырья
Для производства используются субстраты, содержащие глюкозу, сахарозу или крахмал. В случае использования крахмала его сначала подвергают процессу осахаривания, чтобы преобразовать крахмал в глюкозу, которая уже непосредственно идет в производство. В связи с тем, что уровень примесей данных субстратов сильно варьируется, существуют специальные технологии для обработки различных сырьевых материалов. В основном речь идет об операциях обессоливания и последующей непрерывной стерилизации.
Брожение
Наиболее привлекательным с точки зрения потребления энергии, а также одним из наиболее простых с конструкторской точки зрения является применение барботажного ферментера*. Специально отобранные производственные штаммы типа Aspergillus niger и точно подобранные под индивидуальные сырьевые материалы процессы для регулирования метаболической активности микроорганизмов гарантируют наилучшие из возможных выходы и уровни производительности.
(* Барботажный ферментер — ферментер, в котором перемешивание и аэрация культуральной жидкости осуществляется с помощью сжатого воздуха, поступающего через барботер, а отношение высоты аппарата к диаметру не превышает 2).
Выделение лимонной кислоты
Цель выделения лимонной кислоты – получить предварительно очищенный раствор лимонной кислоты из ферментационного раствора. Для этого ферментационный раствор подвергается следующим стадиям процесса:
- отделение мицелия
- осаждение цитрата кальция и сепарация
- разложение цитрата кальция и отделение сульфата кальция
Для отделения сухих остатков используются преимущественно автоматизированные ленточные фильтры. Специально разработанные процессы для выделения осадка и разложения цитрата кальция обеспечивают минимизацию затрат на данной стадии процесса, а также дают высокий уровень воспроизводимости процесса, что существенно влияет на качество конечного продукта.
Очищение и кристаллизация лимонной кислоты
Завершающий этап очистки лимонной кислоты включает в себя взаимодействие раствора лимонной кислоты с активированным углем, катионо- и анионообменными смолами в реакторах с неподвижным слоем. Окончательная обработка продукта включает следующие стадии: выпаривание, вакуумная кристаллизация, выделение кристаллов в центрифуге, сушка с использованием псевдоожиженного слоя, просеивание. Все процессы организованы с высоким уровнем автоматизации.
Оптимально подобранные стратегии измерения и контроля, а также конструкция кристаллизатора позволяют производить моногидрат лимонной кислоты и обезвоженный продукт при помощи одного и того же оборудования. С помощью последующего просеивания высушенного конечного продукта осуществляется подходящее покупателю фракционирование в соответствии с размером частиц. Лимонную кислоту можно получать как в порошкообразном, так и в жидком виде.
Процессы очистки и кристаллизации сочетаются с широким спектром классов продукта, в том числе:
- CAM (citric acid monohydrate) – моногидрат лимонной кислоты; моногидрат означает, что в составе есть молекулы воды.
 То есть моногидрат состоит из самого вещества и молекул воды. Но это не означает, что моногидрат имеет жидкую форму;
То есть моногидрат состоит из самого вещества и молекул воды. Но это не означает, что моногидрат имеет жидкую форму; - CAA (Citric acid anhydrous) – ангидрат лимонной кислоты – безводная лимонная кислота, представляет собой мелкокристаллический порошок белого цвета. В отличие от моногидрата в ее кристаллической решетке нет молекул воды, только лимонная кислота, поэтому она и называется безводной. Она является идеальным подкислителем при производстве тех продуктов, где присутствие воды даже в кристаллическом виде может нанести ущерб потребительским качествам готового продукта;
- сироп;
- цитрат натрия.
Все виды продукции соответствуют международным стандартам качества пищевого, промышленного и фармацевтического классов, в том числе BP, USP и FCC.
Читать по теме: Глюкоза – основной продукт глубокой переработки зерновых
В прилагаемой таблице приведены показатели потребления энергии и вспомогательных материалов, которые определяют реализацию процесса. При оценке этих факторов следует учитывать, что параметры, влияющие на потребление электроэнергии, воды и пара являются также зависимыми от месторасположения завода.
При оценке этих факторов следует учитывать, что параметры, влияющие на потребление электроэнергии, воды и пара являются также зависимыми от месторасположения завода.
| № п/п | Параметр | Ед. изм. | Потребление на 1 тонну моногидрата лимонной кислоты |
| 1 | Гашеная известь (70% СаО) | кг | 710-750 |
| 2 | Соляная кислота (30%) | кг | 170-190 |
| 3 | Серная кислота (94%) | кг | 860-910 |
| 4 | Щелочь натрия (50%) | кг | 140-160 |
| 5 | Вода для процесса | м3 | 50-56 |
| 6 | Деионизированная вода | м3 | 11-14 |
| 7 | Пар 9 бар | кг | 8 500–9 000 |
| 8 | Электроэнергия | кВт ч | 1 950–2 100 |
Минимальная рекомендуемая мощность завода по производству лимонной кислоты составляет 20 тыс.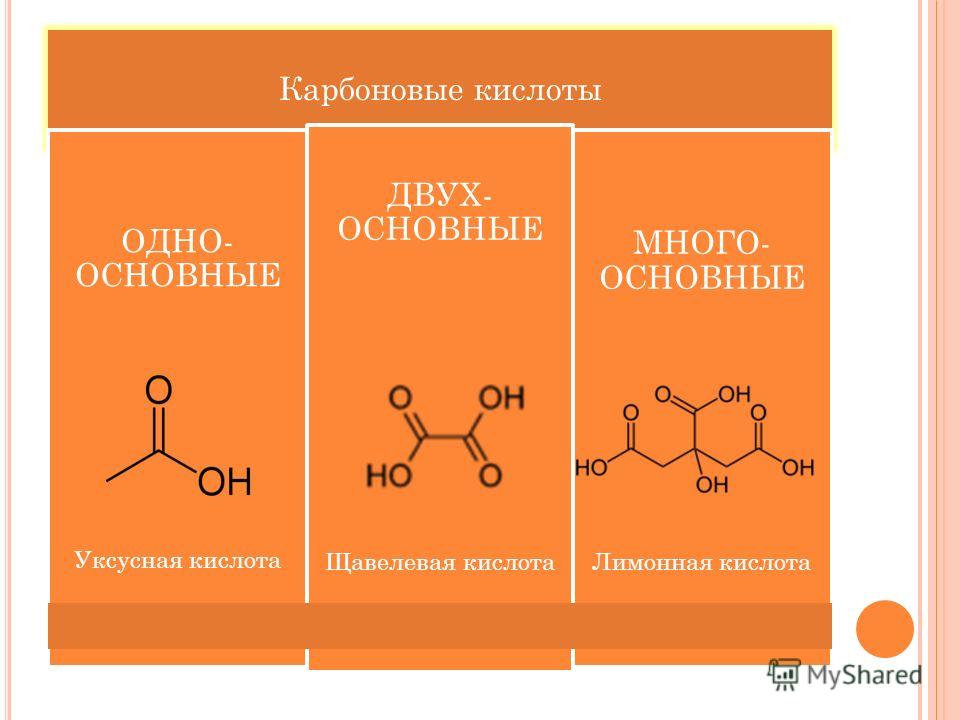 тонн в год. Для завода такой мощности требуется 5-7 га земли. Капиталовложения зависят от мощности и конфигурации завода, а также от местных условий. Стоимость технологической установки (за исключением здания, вспомогательных конструкций и инфраструктуры) составляет около 40 млн евро. Данная цифра приведена для общего представления, поскольку в каждом проекте есть свои особенности, которые необходимо учитывать. При условии наличия разрешений проектирование и строительство завода занимают около 24-30 месяцев.
тонн в год. Для завода такой мощности требуется 5-7 га земли. Капиталовложения зависят от мощности и конфигурации завода, а также от местных условий. Стоимость технологической установки (за исключением здания, вспомогательных конструкций и инфраструктуры) составляет около 40 млн евро. Данная цифра приведена для общего представления, поскольку в каждом проекте есть свои особенности, которые необходимо учитывать. При условии наличия разрешений проектирование и строительство завода занимают около 24-30 месяцев.
В нашей следующей публикации мы планируем представить один из самых интересных и перспективных продуктов глубокой переработки зерновых – экстракт дрожжей.
Малицкий Александр, CEO в компании Integraferm EU (Австрия).
Специалист по управлению проектами. Имеет десятки реализованных проектов в сферах строительства и реконструкции заводов, создания совместных производств, АСУ ТП в области энергетики, внедрения ERP систем, Social Media Marketing. В 2015 — 2017 годах прошел в европейских компаниях переподготовку по маркетингу и продажам, организации производства, биотехнологиям и процессам глубокой переработки зерна. С 2018 года активно продвигает в Украине проекты глубокой переработки зерновых.
В 2015 — 2017 годах прошел в европейских компаниях переподготовку по маркетингу и продажам, организации производства, биотехнологиям и процессам глубокой переработки зерна. С 2018 года активно продвигает в Украине проекты глубокой переработки зерновых.
Понравилось это:
Нравится Загрузка…
Чем заменить лимонную кислоту? — Руководства ✓ Журнал, советы, учебные пособия и обзоры
Лимонный сок. Он встречается во многих домашних хозяйствах и является отличной заменойлимонная кислота. … Есть около 3 граммовлимонная кислота в лимонном соке и добавьте 4-5 столовых ложек лимонного сока на каждую столовую ложкулимонная кислота просили по рецепту.
кроме того, как получить лимонную кислоту? Путем смешивания насыщенного лимонного сока с известковой водой, которая разлагаетсякислота серная, получаемлимонная кислота. Промежуточным продуктом этой реакции является цитрат кальция.
Уксусная кислота это уксус? Я’уксусная кислота бесцветная жидкость из семейства карбоновых кислот.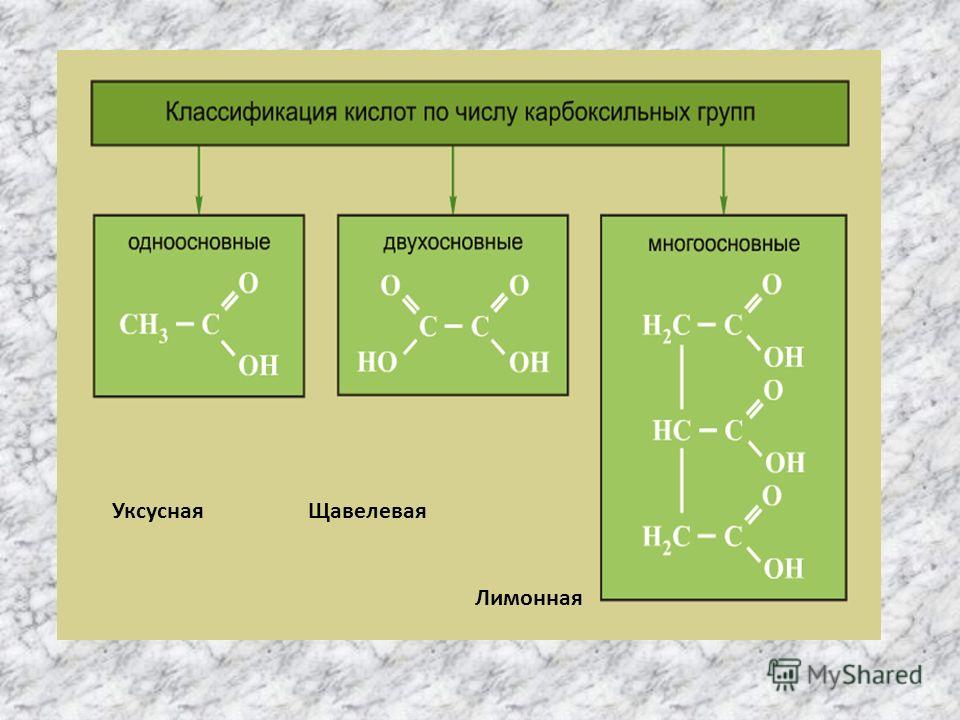 Его химическая формула является СН3-СО-ОН. ПРОТИВ’является один из старейших пищевых консервантов: римляне называли его «ацетум», уксус. …Широко используемый в промышленности,уксусная кислота простой реагент для производства в больших количествах.
Его химическая формула является СН3-СО-ОН. ПРОТИВ’является один из старейших пищевых консервантов: римляне называли его «ацетум», уксус. …Широко используемый в промышленности,уксусная кислота простой реагент для производства в больших количествах.
В чем польза лимонной кислоты? Л’лимонная кислота идеально подходит для удаления известкового налета с унитазов, удаления накипи с бытовой техники (чайник, кофеварка, стиральная машина и т. д.) или даже для удаления следов известкового налета и придания ему блеска la смесители, перегородки и экраны для душа, керамика для ванной…
содержание
Чем заменить винную кислоту?
Чем заменить винную кислоту на кухне ? Во многих рецептах (джемы, мармелады, напитки и др.)Винная кислота может быть замещать ккислота лимонная кислота в том же количестве. Эти двое кислоты имеют по существу одинаковые свойства.
Итак, как сделать домашнюю лимонную кислоту? Путем смешивания насыщенного лимонного сока с известковой водой, которая разлагаетсякислота серная, получаемлимонная кислота. Промежуточным продуктом этой реакции является цитрат кальция.
Промежуточным продуктом этой реакции является цитрат кальция.
Где найти лимонную кислоту во Франции? Подойдите ближе к ремесленным магазинам. Я’лимонная кислота в безводной форме доступен в отделе товаров для мыловарения в магазинах для рукоделия.
Как производить кислоту? Исходный материал для изготовлениякислота Серный газ – это диоксид серы (SO2), чистый и сухой. Ее можно получить путем сжигания жидкой серы, из металлургических газов или путем разложениякислота отработанная серная.
В чем разница между уксусной кислотой и уксусом?
Le уксус представляет собой водный раствор, состоящий в основном изуксусная кислота. Это натуральный и биоразлагаемый продукт, полученный в результате биотрансформации этилового спирта, присутствующего в вине или сидре.
Как иначе называется уксусная кислота? Я’уксусная кислота ou кислота этнический является un кислота органический. Его химическая формула является СН3СООН. Я’уксусная кислота в то время как является бесцветная легковоспламеняющаяся жидкость.
Я’уксусная кислота в то время как является бесцветная легковоспламеняющаяся жидкость.
Какой кислотой является уксус?
Состав уксус из водного раствора этанола. Большинство уксусов, приготовленных из водного раствора этанола, имеют содержание кислота уксусной кислоты примерно от 5 до 8% по массе, а также низкое содержание кислота виннокаменная и кислота лимонный.
Как чистить унитаз лимонной кислотой? Используется для растворения ржавчины и известкового налета.лимонная кислота также будет вашим союзником, чтобы очистить ваши туалеты от накипи. Для этого добавьте 4 столовые ложкикислота в пол-литра воды, которую вы будете нагревать. Внимание, важно носить перчатки, чтобы использовать эту смесь без риска.
Как использовать лимонную кислоту для чистки?
Уборка керамические, нержавеющие или хромированные поверхности и стены de душ (стеклянный или пластиковый): растворить от 2 до 5 столовых ложеклимонная кислота в 1 л горячей воды, протереть этим раствором поверхности, хорошо промыть.
Как использовать лимонную кислоту в кулинарии?
– Для застывания варенья: в конце варки варенья добавить несколько граммовлимонная кислота в еще теплом варенье. — Для щербета: в литр воды положить сахарную пудру, глюкозу,лимонная кислота, и процедить в мороженицу.
Где я могу найти коммерческую лимонную кислоту? Лимонная кислота 1 кг: Amazon.co.uk: Кухня и дом.
Почему винная кислота хиральна? Натуральный продукт, известный древним как винный камень,Винная кислота придает кислотность вину и был у истоков открытия хиральности органических соединений (…). … яВинная кислота натуральный хиральный, что означает, что это является состоят из молекул, изображение которых в зеркале не является не накладывается.
Как подкислить сусло?
Винная кислота часто является предпочтительным сырьем для подкислитель ле обязан.
Как сделать самодельный антиизвестняк? Пищевая сода
Смешайте 1/3 пищевой соды с одним объемом воды и нанесите на участки, загрязненные камнем, сформируйте пасту. Оставьте минимум на 1/2 часа, затем энергично потрите жесткой щеткой.
Оставьте минимум на 1/2 часа, затем энергично потрите жесткой щеткой.
Как приготовить раствор кислоты?
Один решение водныйкислота лимонная кислота в высокой концентрации сохраняется лучше и дольше, чем решение легче. Хороший компромисс приготовить раствор в равных частях (по массе) воды и порошка (например, 500 г порошка на 500 мл воды).
Как приготовить раствор кислоты? в случае решение мать изкислота концентрированный, так как избегайте попадания воды накислота концентрированный, мы предварительно наполним колбу дном дистиллированной воды и введемкислота с осторожностью. Флакон следует наполнить дистиллированной водой до дна горлышка.
Опасна ли лимонная кислота?
L ‘лимонная кислота-Он опасно ? Вовсе нет, даже если вам придется соблюдать некоторые условия использования. Действительно, это может раздражать глаза и кожу, а также является рекомендуется носить перчатки при его использовании.
Каковы преимущества лимонной кислоты? Если его репутация как средства для удаления накипи и накипи хорошо зарекомендовала себя, мы также предоставляемлимонная кислота дезинфицирующие свойства. Он действует не только как антибактериальное, но и как фунгицидное средство.
Как почистить унитаз лимонной кислотой?
Используется для растворения ржавчины и известкового налета.лимонная кислота также будет вашим союзником для удаления накипи туалетный. Для этого добавьте 4 столовые ложкикислота в пол-литра воды, которую вы будете нагревать. Внимание, важно носить перчатки, чтобы использовать эту смесь без риска.
Не забудьте поделиться статьей ✨
Типы кислотности | кулинария
разработка рецептов
Автор Престон Ландерс
Выжатый лимон. Всплеск уксуса.
Всплеск уксуса.
Скорее всего, вы уже добавляете кислоту в свои блюда.
Но задумываетесь ли вы о том, какой тип кислотности использовать для данного блюда? В этом посте я описываю различные типы кислотности и то, как вы можете использовать каждый из них в своей кулинарии.
Что такое кислотность?
Для поваров кислотность – это контроль. При разумном использовании кислотность может осветлить тяжелое или жирное блюдо, привлечь внимание к более тонким вкусам в блюде или добавить сложности. Кислотность также может уменьшить восприятие сладости и горечи или уменьшить количество соли, необходимой для баланса вашего блюда.
При добавлении кислот в рецепт полезно думать о кислотности не как о вкусе, а как о категории вкусов. Существуют разные типы кислотности, и у каждого типа есть свои плюсы и минусы. Знание того, к какому типу кислотности стремиться (или знание того, когда комбинировать типы кислотности, чтобы сделать блюдо более интересным), сделает ваши блюда более сплоченными и продуманными.
Итак, давайте рассмотрим типы кислотности — что это такое, для чего они нужны и где их найти.
CiTRIC Acid
Когда большинство людей думают о кислотности, они думают о лимонной кислоте. Это потому, что лимонная кислота является основной кислотой в цитрусовых, таких как лимон, лайм, грейпфрут, апельсин и юзу. В меньших количествах лимонная кислота содержится и в других фруктах и овощах (например, в томатах).
Для меня лимонная кислота на вкус как солнечный свет раннего утра. Он яркий, напористый и может постоять за себя. Это самая кислая (то есть самая низкая по шкале pH) из популярных кислот.
Когда использовать лимонную кислоту
Я предпочитаю использовать лимонную кислоту в блюдах, которые я хочу попробовать свежими . Подумайте о салатах или блюдах из белой рыбы. Например, при обжаривании овощей вы можете обнаружить, что вкус ваших овощей стал менее ярким после того, как вы их приготовили; выжимка лимона может оживить приготовленные овощи, придав им вкус, который больше напоминает овощи в сыром виде.
Лимонная кислота теряет большую часть своего характерного запаха при нагревании. Вы можете использовать это в своих интересах, если надеетесь подавить лимонную кислоту (например, приготовление апельсинов с тушеной уткой), или вы можете добавить цитрусовые в конце процесса приготовления.
Где найти лимонную кислоту
Хотите верьте, хотите нет, но в кожуре или цедре цитрусовых не так много лимонной кислоты. Фактически, цедра лаймов и лимонов, которые я тестировал, имела почти идеально нейтральный pH! Так что лучший выбор — цитрусовый сок.
Помимо цитрусовых, вы также можете купить чистую лимонную кислоту. Это может быть полезно, если вы хотите использовать лимонную кислоту без ароматизаторов (особенно сладости), которые сопровождают цитрусовые. Я часто использую порошок лимонной кислоты в leche de tigre для своего севиче, когда хочу лучше контролировать уровень кислоты. Этот метод позволяет мне мариновать сырые морепродукты в жидкости, такой как креветочный бульон, вместо того, чтобы использовать только цитрусовый сок.
Молочная кислота
Молочная кислота является основным привкусом, связанным с лактоферментацией. Если вы пробовали соленые огурцы, квашеную капусту, кимчи, мисо или йогурт, вы пробовали молочную кислоту. Кислотность даже хлеба на закваске частично обусловлена молочной кислотой.
Я думаю о молочной кислоте, как о включении света в гостиной. Это более мягкое и округлое сияние, чем у лимонной кислоты — почти молочное. Я обычно ассоциирую молочную кислоту с некоторой причудливостью, отчасти потому, что она обычно получается в результате ферментации какого-либо другого ингредиента.
Когда использовать молочную кислоту
Я использую молочную кислоту в блюдах, которым нужна бодрящая нота, которая не отвлекает. Землистые бульоны или соусы, приправленные молочной кислотой, по-прежнему кажутся землистыми, но, тем не менее, более легкими.
Я часто добавляю яркости овощным блюдам, приправляя их лакто-ферментированным ядом. Например, при приготовлении пюре из корня сельдерея я считаю, что добавление лимона (т.е. лимонной кислоты) слишком заметно — это не место! Поэтому вместо пюре из корня сельдерея я добавляю ферментированный корень сельдерея.
Например, при приготовлении пюре из корня сельдерея я считаю, что добавление лимона (т.е. лимонной кислоты) слишком заметно — это не место! Поэтому вместо пюре из корня сельдерея я добавляю ферментированный корень сельдерея.
Где найти молочную кислоту
Лучший способ найти молочную кислоту — это сбродить что-нибудь! Лактоферментация проста, и она позволяет вам добавить в ваши блюда тонкий вкус. Я также люблю консервировать лимоны, чтобы смягчить лимонную кислоту цитрусовых небольшим количеством молочной кислоты.
Но вам не обязательно полагаться на ферментацию, чтобы добавить в блюда молочную кислоту. Вы также можете купить порошкообразную молочную кислоту и добавлять ее по мере необходимости. У меня есть запас порошка молочной кислоты, который я добавляю в свой рецепт дрожжевого теста для пиццы, чтобы имитировать кислый вкус хлеба на закваске.
Уксусная кислота
Уксусная кислота — это кислотность, которую вы ассоциируете с уксусом или чайным грибом. Он также содержится в следовых количествах в хлебе на закваске (наряду с молочной кислотой) и винах (особенно в натуральном вине или винах, описываемых как имеющие «летучую кислотность»). Уксусная кислота обычно образуется при ферментации спирта в присутствии кислорода.
Он также содержится в следовых количествах в хлебе на закваске (наряду с молочной кислотой) и винах (особенно в натуральном вине или винах, описываемых как имеющие «летучую кислотность»). Уксусная кислота обычно образуется при ферментации спирта в присутствии кислорода.
Я думаю об уксусной кислоте, как о свете фонарика на более тяжелые элементы вашей посуды. Отчасти благодаря своему резкому запаху, он немного выделяется, никогда не смешиваясь с другими ингредиентами.
Когда использовать уксусную кислоту
Прелесть уксусной кислоты заключается в доступности разновидностей уксуса. От рисового винного уксуса до бальзамического и всего, что между ними, легко найти уксус, который дополнит ваш салат или основное блюдо.
В большей степени, чем другие типы кислотности, уксус нуждается в жирах, чтобы дополнить его кислотность и смягчить запах. Для этой цели хорошо подходят эмульсии уксуса и сливочного или оливкового масла.
Где найти уксусную кислоту
Я не просто покупаю уксус. Я тоже их делаю. Домашний уксус (особенно приготовленный из фруктов и овощей) может иметь более густое ощущение во рту и более сладкий вкус, что делает его более сбалансированным и почти самостоятельным соусом. Руководство Noma по ферментации — это невероятный ресурс для приготовления собственного уксуса.
Я тоже их делаю. Домашний уксус (особенно приготовленный из фруктов и овощей) может иметь более густое ощущение во рту и более сладкий вкус, что делает его более сбалансированным и почти самостоятельным соусом. Руководство Noma по ферментации — это невероятный ресурс для приготовления собственного уксуса.
Когда я не планирую приготовление уксуса на несколько месяцев вперед, я также предпочитаю ароматизировать нейтральные уксусы (например, уксус из белого вина). Например, перед приготовлением грибов я могу добавить кусочки грибов в уксус, который планирую использовать на следующий день.
Чаще всего я выбираю очень крепкий уксус под названием аттика. Уксус ättika из Швеции в четыре раза крепче обычного уксуса, поэтому он хорошо работает, когда вы хотите отрегулировать кислотность, не придавая посторонние вкусы. У меня есть небольшой пульверизатор с уксусом эттика, который я использую, чтобы сбрызнуть блюдо, когда понимаю, что оно не такое кислое, как я надеялся.
Яблочная кислота
Яблочная кислота — это кислотность зеленого яблока. Это также основная кислота, содержащаяся в абрикосах, ежевике, чернике, вишне, сливе мирабель, персиках, грушах и айве. Дешевое белое кулинарное вино на мой вкус похоже на яблочную кислоту.
Это также основная кислота, содержащаяся в абрикосах, ежевике, чернике, вишне, сливе мирабель, персиках, грушах и айве. Дешевое белое кулинарное вино на мой вкус похоже на яблочную кислоту.
Я думаю о яблочной кислоте, как о солнечном свете сквозь витражное окно. Он мягче, чем лимонная кислота, и я могу описать его только как теплый.
В яблочном салате в Noma использовались яблочная, лимонная и молочная кислоты для придания загадочного фруктового вкуса.
Когда использовать яблочную кислоту
Я считаю, что яблочная кислота хорошо подходит для оживления мясных блюд, особенно свинины. Он хорошо сочетается со сладостью, что делает его идеальным для десертов.
Я редко использую яблочную кислоту саму по себе, но стараюсь добавлять ее в уже кислые блюда, чтобы сделать их более сложными. Соус с несколькими типами кислотности может быть на вкус как целая корзина с фруктами! Например, я часто добавляю в масляные соусы и белое вино, и уксус (т. е. смешиваю яблочную кислоту с уксусной кислотой). Точно так же ферментация ежевики — это способ добавить молочную кислоту в ягоды, богатые яблочной кислотой.
е. смешиваю яблочную кислоту с уксусной кислотой). Точно так же ферментация ежевики — это способ добавить молочную кислоту в ягоды, богатые яблочной кислотой.
Где найти яблочную кислоту
Я держу под рукой немного разбавленного белого вина, чтобы регулировать яблочную (и винную) кислотность в блюдах. В противном случае я держу под рукой порошкообразную яблочную кислоту, чтобы регулировать жидкости, которые я использую в своем севиче.
Другие кислоты
Четыре кислоты, которые я описал, только царапают поверхность. Но у других кислот не так много кулинарных применений.
Щавелевая кислота (содержится в щавеле, шнитт-луке и портулаке), безусловно, полезна (и напоминает уксусную кислоту), но чрезмерное потребление щавелевой кислоты может быть токсичным. Винная кислота является преобладающим ароматизатором тамаринда и играет важную роль в снижении pH при производстве вина. Его также смешивают с пищевой содой, чтобы получить разрыхлитель. Между тем, аскорбиновая кислота тоже распространена — потому что это витамин С!
Между тем, аскорбиновая кислота тоже распространена — потому что это витамин С!
Заключение
Надеюсь, это было полезно. И когда жизнь преподносит вам лимоны, дважды подумайте, действительно ли эта кислотность нужна жизни прямо сейчас.
Престон Ландерс
Плотность водных растворов органических кислот
Обратите внимание на единицы концентрации на рисунках:
% масс.: Масса растворенного вещества/общая масса раствора*100%
моль/кг: Моляльность = моли раствор/кг вода
моль/литр: Молярность = количество молей растворенного вещества/литр раствора
Значения приведены в таблице под рисунками.
См. также плотность водных растворов органических веществ, таких как сахара и спирты, неорганические хлориды, неорганические соли натрия, неорганические соли калия и некоторые другие неорганические вещества
г/см 3 :
Для просмотра полной таблицы со щавелевой и трихлоруксусной кислотами — поверните экран!
| Mass% | Acetic acid | Citric acid | Formic acid | D-Lactic acid | Oxalic acid | Trichloroacetic acid | |||||||
| 1 | 0,9996 | 1,0022 | 1,0006 | 1. 0002 0002 | 1.0030 | 1.0034 | |||||||
| 5 | 1.0052 | 1.0189 | 1.0102 | 1.0086 | 1.0220 | 1.0230 | |||||||
| 10 | 1.0121 | 1.0402 | 1.0224 | 1.0199 | 1,0479 | ||||||||
| 20 | 1,0250 | 1,0858 | 1,0467 | 1,0439 | 1,1035 | 1,0439 | 1,1035 | 1,0439 | 1,1035 | ||||
| 1,1035 | 0203 | ||||||||||||
| 30 | 1.0369 | 1.1346 | |||||||||||
| 40 | 1.0474 | 1.0935 | 1.0915 | 1.2188 | |||||||||
| 50 | 1.0562 | 1.2803 | |||||||||||
| 60 | 1,1392 | ||||||||||||
| 70 | 1,0673 | ||||||||||||
| 80 | 1.1848 | ||||||||||||
| 100 | 1.0477 | ||||||||||||
| Density of acids solved in water at 20°C, given as wt% | |||||||||||||
Перевод концентрации из массовых % в моль/кг (моль растворенного вещества/кг воды = моляльность):
Для полной таблицы со щавелевой и трихлоруксусной кислотой — повернуть экран!
| Mass% | Acetic acid | Citric acid | Formic acid | D-Lactic acid | Oxalic acid | Trichloroacetic acid | |||
| 1 | 0,168 | 0,053 | 0,219 | 0,112 | 0,112 | 0,60200203||||
| 5 | 0. 876 876 | 0.274 | 1.143 | 0.584 | 0.585 | 0.322 | |||
| 10 | 1.850 | 0.578 | 2.414 | 1.233 | 0.680 | ||||
| 20 | 4.163 | 1,301 | 5.410 | 2.775 | 1,530 | ||||
| 30 | 7.137 | 2,23192030274 | |||||||
| 40 | 11.102 | 14.483 | 7.401 | 4.080 | |||||
| 50 | 16.653 | 6.120 | |||||||
| 60 | 16.652 | ||||||||
| 70 | 38.857 | 50.692 | |||||||
| 80 | 03 | 0274 | 44.405 | ||||||
| моль/кг раствор при 20 ° C | |||||||||
Преобразование концентрации от массовой% в молит/литр (молит порезы/литературу). полная таблица со щавелевой и трихлоруксусной кислотами — повернуть экран!
полная таблица со щавелевой и трихлоруксусной кислотами — повернуть экран!
| % масс.0020 | D-Lactic acid | Oxalic acid | Trichloroacetic acid | |||||
| 1 | 0.166 | 0.052 | 0.217 | 0.111 | 0.111 | 0.061 | ||
| 5 | 0,837 | 0,265 | 1,097 | 0,560 | 0,568 | 0,313 | ||
| 10 | 1,685 | |||||||
| 10 | 1,685 | |||||||
| 10 | 1,685 | 0.541 | 2.221 | 1.132 | 0.641 | |||
| 20 | 3.414 | 1.254 | 4.548 | 2.318 | 1.351 | |||
| 30 | 5.180 | 1.772 | ||||||
| 40 | 6. 977 977 | 9.502 | 4.847 | 2,984 | ||||
| 50 | 8.7999999999999 | 50 | 8.799999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999999н4 | 3.918 | ||||
| 60 | 7.588 | |||||||
| 70 | 12.441 | 17.619 | ||||||
| 80 | 10.522 | |||||||
| 100 | 17,447 | |||||||
| Моль/литр раствора при 20°C | ||||||||
15.1: Кислоты: свойства и примеры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 118863
Цели обучения
- Изучить свойства кислот.

Многие любят пить кофе. Чашка первым делом с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Известковые отложения накапливаются через некоторое время и замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и запустить цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускорит процесс заваривания до его первоначальной скорости. Просто не забудьте пропустить воду через процесс заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень распространены в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, описанных ниже:
- Водные растворы кислот являются электролитами, то есть они проводят электрический ток.
 Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде.
Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде. - Кислоты имеют кислый вкус. Лимоны, уксус и кислые леденцы содержат кислоты.
- Кислоты изменяют цвет некоторых кислотно-щелочных индикаторов. Двумя распространенными индикаторами являются лакмус и фенолфталеин. Синий лакмус в присутствии кислоты становится красным, а фенолфталеин обесцвечивается.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что ряд активности — это список металлов в порядке убывания реакционной способности. Металлы, находящиеся выше водорода в ряду активности, заменят водород из кислоты в реакции одинарного замещения, как показано ниже:
\[\ce{Zn} \left( s \right) + \ce{H_2SO_4} \left( aq \right) \rightarrow \ce{ZnSO_4} \left( aq \right) + \ce{H_2} \left (г \справа) \label{eq1} \] - Кислоты реагируют с основаниями с образованием соединения соли и воды.
 При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.
При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что список оснований немного сложнее). Ниже приведен неполный список некоторых распространенных кислот, а также некоторые химические формулы:
Имя химика | Общее название | Использование |
|---|---|---|
| соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота — HCl | Применяется при очистке (рафинировании) металлов, при уходе за бассейнами и для бытовой уборки. |
| серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
| азотная кислота, HNO 3 | Используется в производстве удобрений, взрывчатых веществ и при добыче золота. | |
| уксусная кислота, УВ 2 H 3 O 2 | уксус | Основной ингредиент уксуса. |
| угольная кислота, H 2 CO 3 | отвечает за «шипение» в газированных напитках | В качестве ингредиента газированных напитков. |
| лимонная кислота, C 6 H 8 O 7 | Используется в пищевых продуктах и пищевых добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
| ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 )CO 2 H | аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
Соляная кислота
Соляная кислота представляет собой коррозионную сильную минеральную кислоту, которая используется во многих отраслях промышленности. Бесцветный, очень резкий раствор хлороводорода (HCl) в воде. Соляную кислоту обычно получают обработкой \(\ce{HCl}\) водой. 9{-} (aq) } \nonumber \]
Соляную кислоту обычно получают обработкой \(\ce{HCl}\) водой. 9{-} (aq) } \nonumber \]
Таким образом, соляную кислоту можно использовать для получения хлористых солей. Соляная кислота является сильной кислотой, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота представляет собой сильно коррозионную сильную минеральную кислоту с молекулярной формулой \(\ce{h3SO4}\). Серная кислота является двухосновной кислотой и имеет широкий спектр применения, включая использование в бытовых кислотных очистителях канализации, [] в качестве электролита в свинцово-кислотных батареях и в различных чистящих средствах. Это также центральное вещество в химической промышленности.
Рисунок \(\PageIndex{1}\): Капли концентрированной серной кислоты быстро разлагают кусок хлопчатобумажного полотенца в результате обезвоживания. (CC BY-SA 3.0; Токсичный Уокер).
Поскольку гидратация серной кислоты термодинамически выгодна (и сильно экзотермична) и ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень мощным обезвоживающим свойством, удаляя воду (\(\ce{h3O}\)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло, пар. Серная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов с образованием газообразного водорода (уравнение \ref{Eq1}).
\[\ce{M + h3SO4 → M(SO4) + h3 } \label{Eq1} \]
Азотная кислота
Азотная кислота (\(\ce{HNO3}\)) является очень агрессивной минеральной кислотой а также обычно используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем взаимодействия диоксида азота (\(\ce{NO_2(g)}\)) с водой.
\[\ce{3 NO2(г) + h3O (ж)→ 2 HNO3 (г) + NO(г)} \номер \]
Азотная кислота реагирует с большинством металлов, но подробности зависят от концентрации Кислота и природа металла. Разбавленная азотная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет \(\ce{h3}\) газ):
Разбавленная азотная кислота ведет себя как обычная кислота при взаимодействии с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет \(\ce{h3}\) газ):
\[\ce{Mg + 2 HNO3 → Mg(NO3)2 + h3 } \номер \]
\[\ce{Mn + 2 HNO3 → Mn(NO3)2 + h3 } \номер \]
\[\ce{Zn + 2 HNO3 → Zn(NO3)2 + h3 } \номер \]
Азотная кислота является коррозионно-активной кислотой и сильным окислителем. Главной опасностью, которую он представляет, является химический ожог, так как он осуществляет кислотный гидролиз белков (амид) и жиров (эфир), что приводит к разложению живой ткани (Рисунок \(\PageIndex{2}\)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином 9.0003 Рисунок \(\PageIndex{2}\): Ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).
Углекислота
Углекислота — это химическое соединение с химической формулой \(\ce{h3CO3}\), а также это название, которое иногда дается растворам диоксида углерода в воде (газированная вода), поскольку такие растворы содержат небольшое количество \(\ce{h3CO3(водн. )}\). Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии угольная кислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к появлению многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота является полипротонной кислотой, в частности, она является двухосновной, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
)}\). Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии угольная кислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к появлению многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота является полипротонной кислотой, в частности, она является двухосновной, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда двуокись углерода растворяется в воде, она находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\[\ce{CO2 + h3O <=> h3CO3} \nonumber \]
Реакция может быть подталкивается к тому, чтобы реагенты генерировали \(\ce{CO2(g)}\) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рис. \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\(\ce{HCO2H}\)) является простейшей карбоновой кислотой и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравьиный» происходит от латинского слова formica, обозначающего муравья, что указывает на его раннюю изоляцию путем перегонки тел муравьев. Муравьиная кислота широко встречается в природе в виде формиата сопряженного основания.
Слово «муравьиный» происходит от латинского слова formica, обозначающего муравья, что указывает на его раннюю изоляцию путем перегонки тел муравьев. Муравьиная кислота широко встречается в природе в виде формиата сопряженного основания.
Лимонная кислота
Лимонная кислота (\(\ce{C6H8O7}\)) представляет собой слабую органическую трикарбоновую кислоту, которая естественным образом содержится в цитрусовых. Ион цитрата является промежуточным звеном в Цикл TCA (цикл Кребса), центральный метаболический путь животных, растений и бактерий. Поскольку это одна из самых сильных пищевых кислот, лимонная кислота в основном используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \(\PageIndex{4}\): Лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспаления.
 То есть моногидрат состоит из самого вещества и молекул воды. Но это не означает, что моногидрат имеет жидкую форму;
То есть моногидрат состоит из самого вещества и молекул воды. Но это не означает, что моногидрат имеет жидкую форму; 1586
1586
 Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде.
Некоторые кислоты являются сильными электролитами, так как полностью ионизируются в воде, образуя большое количество ионов. Другие кислоты являются слабыми электролитами, существующими в основном в неионизированной форме при растворении в воде. При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.
При соединении равных молей кислоты и основания кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначаемое как соль, и вода.