Металлический блеск металлов: чем объяснить металлический блеск от металлов?
Чем обусловлен металлический блеск металлов
Металлы блеск — Справочник химика 21
Металлы обладают металлическим блеском, если они находятся в крупнокристаллическом состоянии. Порошкообразные металлы блеска не имеют. Исключение составляют лишь магний и алюминий, которые и в мелкораздробленном состоянии сохраняют свой блеск. [c.235]МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с. обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Если необходимо показать некоторые физические свойства металлов (блеск, цвет), можно продемонстрировать образцы (по возможности, крупные) различных металлов Ре, А1, Мд, 2п, Сг, Т1, Си, 8п, РЬ и др. Для сравнения можно показать и образцы неметаллов.

Алюминий — серебристо-белый легкий металл, р = 2,699 г/см , 660,24 С, i .,j,= 2500 С. Он очень пластичен, легко прокатывается в фольгу к протягивается в проволоку. Прекрасный проводник электрического тока — его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида АЬОз. Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск). [c.150]
Иод I 2 AI = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,940 [c.65]
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны. [c.29]
Соблюдение этих условий дало возможность получить светлое качественное покрытие с максимальной толщиной 10—12 мк на медной основе, с содержанием таллия 12,5—22,4 вес. %. Покрытие имеет хорошее сцепление с поверхностью основного металла.
Применяют для придания металлу блеска при никелирований. [c.1001]
Следует подчеркнуть, что положение этой граничной диагонали и само деление элементов на металлы и неметаллы весьма условны. Целый ряд элементов, обладая характерными физическими свойствами металлов — блеском, высокой электропроводностью, пластичностью, проявляет химические свойства двойственной природы — [c.109]
Сложных веществ насчитывается в природе сотни тысяч, простых около двухсот, а элементов, из которых образуются все вещества, известно 92. Большее количество известных простых веществ в сравнении с количеством элементов объясняется свойством последних образовать несколько простых веществ. Например, общеизвестные вещества — уголь, графит и алмаз, резко различающиеся по своим свойствам, являются видоизменениями одного и того же химического элемента — углерода.
Класс 3. Карбиды промежуточного типа представляют собой огнеупорные материалы с некоторыми характерными свойствами металлов (блеск, металлическая проводимость) и, кроме того, отличаются необычной твердостью и тугоплавкостью. Атомы металла в них плотно упакованы, а атомы С занимают октаэдрические пустоты, но следует отметить, что упорядочение атомов металла в карбиде не всегда такое, как в самом металле. В таких случаях карбид МС нельзя рассматривать как предельный твердый раствор углерода в структуре металла наоборот, присутствие атомов С влияет на упорядочение [c.50]
Иод I2 Ai = 253,81 фиол. -черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
-черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
В свободном металле атомы плотно заполняют пространство, а их наружные энергетические уровни, весьма слабо заполненные электронами, перекрывают друг друга. Благодаря этому наружные электроны легко переходят от атома к атому, так что принадлежат не отдельному атому, а как бы обобществлены. Таким образом ионы металла (ядра с внутренними энергетическими уровнями) крепко связываются в одно целое суммой свободно блуждающих между ними электронов. Эти свободные электроны обусловливают и физические свойства металлов (блеск, тепло- и электропроводность и пр.).
В связи с большим разнообразием вопросов, решаемых при изучении электроосаждения металлов, методы, применяемые в этой области, также очень разнообразны и охватывают не только электрохимические, но и физические, механические и другие способы исследования. Это связано с тем, что при электроосаждении металлов изучают как кинетику электродных процессов, так и физико-механические свойства металлов, блеск, пористость, сцепляемость и другие свойства электролитических осадков. Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Роспись фаянсовых и фарфоровых изделий проводят с использованием окислов и солей металлов, которые при обжиге переходят в силикаты, обладающие различной окраской окись кобальта дает синюю окраску, окись хрома — зеленую, закись урана — черную и т. д. Из солей легко восстанавливающихся металлов (золота и платины) при обх[c.121]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, прочностью на изгиб, стойкостью при эксплуатации на воздухе, внутри и вне помещения, преимущественно в условиях умеренного климата. [c.12]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, эластичностью. С повышением жирности алкидной смолы улучшается эластичность покрытий, но уменьшаются твердость, стойкость к растворителям и маслам, стабильность блеска и цвета при горячей сушке и действии света. [c.47]
[c.47]
Иод 1 2
Металлическая связь и свойства металлов Учебник по химии
Ключевые концепции
- Металл — это решетка положительных металлических «ионов» в «море» делокализованных электронов.
- Металлическая связь означает взаимодействие между делокализованными электронами и ядрами металла.
- Физические свойства металлов являются результатом делокализации электронов, участвующих в металлической связи.
- Физические свойства твердых металлов:
⚛ проводить тепло
⚛ проводят электричество
⚛ обычно высокие температуры плавления и высокие температуры кипения
⚛ крепкий
⚛ ковкий (можно штамповать или придавать форму без разрушения)
⚛ пластичный (может быть вытянут в проволоку)
⚛ металлический глянец
⚛ непрозрачный (отражает свет)
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Физические свойства металлов: проводимость тепла и электричества
Твердые и жидкие металлы проводят тепло и электричество.
Делокализованные электроны могут свободно перемещаться в твердой решетке.
Эти подвижные электроны могут действовать как носители заряда при проведении электричества или как проводники энергии при передаче тепла.
В таблице ниже показана электропроводность (10 6 Ом -1 см -1 ) металлов лития по отношению к индию.
| Группа 1 (Щелочные металлы) | Группа 2 (Щелочноземельные металлы) | Переходные металлы (Группы с 3 по 12) | Группа 13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li 0,108 | Be 0,313 | |||||||||||
| Na 0,210 | мг 0.226 | Al 0,377 | ||||||||||
| К 0,139 | Ca 0,298 | Sc 0,017 | Ti 0,023 | В 0,048 | Cr 0,077 | млн 0,006 | Fe 0,093 | Co 0,172 | Ni 0,143 | Cu 0.  596 596 | Zn 0,166 | Ga 0,067 |
| руб 0,077 | Sr 0,076 | Y 0,016 | Zr 0,023 | Nb 0,069 | Пн 0,187 | Тс 0,067 | Ру 0,137 | Rh 0,211 | Pd 0.095 | Ag 0,630 | Кд 0,138 | В 0,116 |
Физические свойства металлов: высокая температура плавления
Обычно металлы имеют высокие температуры плавления и кипения из-за прочности металлической связи.
Прочность металлической связи зависит от:
- число электронов в делокализованном «море» электронов.
(Более делокализованные электроны приводят к более прочной связи и более высокой температуре плавления.) - упаковка атомов металла.
(Чем плотнее атомы упакованы, тем прочнее связь и выше температура плавления.)
В таблице ниже показаны приблизительные температуры плавления (° C) металлов от лития до индия.
| Группа 1 (Щелочные металлы) | Группа 2 (Щелочноземельные металлы) | Переходные металлы (Группы с 3 по 12) | Группа 13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ли 180.7 | Be 1,278 | |||||||||||
| Na 98 | мг 650 | Al 660 | ||||||||||
| К 63,35 | Ca 839 | SC 1,539 | Ti 1,660 | В 1,902 | Cr 1,857 | млн 1,246 | Fe 1,535 | Co 1,495 | Ni 1,453 | Cu 1,085 | Зн 419.73 | Ga 30 |
| руб 39,64 | Sr 769 | Y 1,526 | злотый 1852 | Nb 2,468 | Пн 2,617 | Тс 2200 | Ру 2,250 | Rh 1,966 | Pd 1,552 | Ag 961 | Кд 321 | В 157 |
Металлы группы 1 (щелочные) имеют относительно низкие температуры плавления по сравнению с другими металлами, потому что они:
- имеют только 1 электрон, чтобы внести свой вклад в делокализованное «море» электронов
- не образуют столько металлических связей, как другие металлы, потому что атомы группы 1 неэффективно упакованы
- имеют большие атомные радиусы, поэтому делокализованные электроны находятся дальше от ядра, что приводит к более слабой металлической связи
Физические свойства металлов: пластичность и пластичность
Металлы ковкие и пластичные.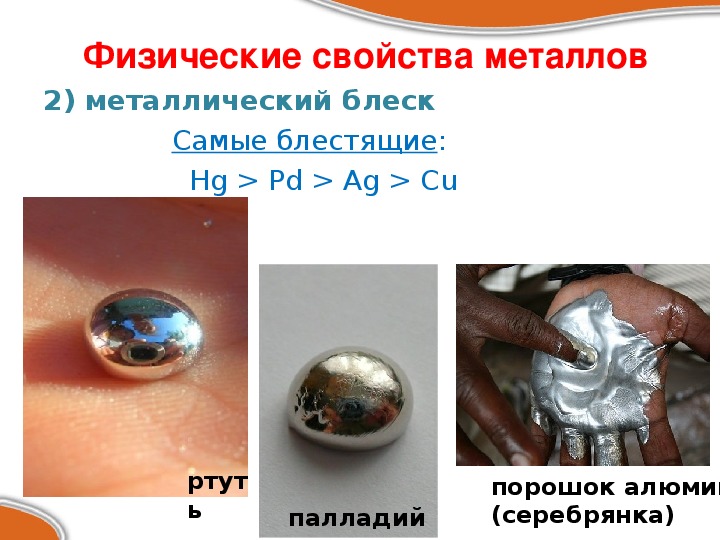
Делокализованные электроны в «море» электронов в металлической связи позволяют атомам металла катиться друг по другу при приложении напряжения.
Физические свойства металлов: оптические свойства
Металлы обычно имеют блестящий металлический блеск.
Фотоны света не проникают очень далеко в поверхность металла и обычно отражаются или отражаются от металлической поверхности.
.2.11 Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Физические свойства металлоидов
- Химические свойства Металлоиды
- Тенденции в металлическом и неметаллическом характере
- Авторы и авторство
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от нементалов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Металлические элементы | Неметаллические элементы |
|---|---|
Отличительный блеск (блеск) | Бесцветный, разные цвета |
Податливый и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
Проводить тепло и электричество | Плохие проводники |
Оксиды металлов основные, ионные | Неметаллические оксиды кислые, соединения |
Катионы в водном растворе | Анионы, оксианионы в водном растворе |
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий жидкий).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга (кусок золота в виде кубика сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле).

- Пластичность: Металлы можно втянуть в проволоку. Из 100 граммов серебра можно сделать тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения.
 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы обычно имеют низкую энергию ионизации, а обычно теряет электроны (т.е.- \]
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не имеют очевидной закономерности, 2 + является обычным явлением, и 1 + и 3 + также наблюдаются
- Соединения металлов с неметаллами обычно ионные по природе
- Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
Na 2 O ( с ) + H 2 O ( л ) -> 2NaOH ( водн. )
)
CaO ( с ) + H 2 O ( л ) -> Ca (OH) 2 ( водн. )
- Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей и воды:
Оксид металла + кислота -> соль + вода
MgO ( с ) + HCl ( водн. ) -> MgCl 2 ( водн. ) + H 2 O ( л )
NiO ( с ) + H 2 SO 4 ( водн. ) -> NiSO 4 ( водн. ) + H 2 O ( л )
Пример
Какова химическая формула оксида алюминия?
Решение
Al имеет заряд 3+, ион оксида — O 2-, таким образом, Al 2 O 3
Пример
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
Al 2 O 3 ( s ) + 6HNO 3 ( водн. ) -> 2Al (NO 3 ) 3 ( водн. ) + 3H 2 O ( л. )
) -> 2Al (NO 3 ) 3 ( водн. ) + 3H 2 O ( л. )
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод).
- Не податливый и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Электропроводность : Плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Класс 2 ( г )
- Br 2 ( л )
- I 2 ( л ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.
 Они имеют электроотрицательный характер.
Они имеют электроотрицательный характер. - Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
Неметалл + металл -> Соль
\ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
- Соединения, полностью состоящие из неметаллов, являются молекулярными веществами (не ионными).
- Обычно они образуют кислые или нейтральные оксиды с кислородом, который, растворяясь в воде, реагирует с образованием кислот:
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {углекислота}} {H_2CO_ {3 (водн.)}} \]
(газированная вода слабокислая)
- Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\ [CO_ {2 (г)} + 2NaOH _ {(водн)} \ rightarrow Na_2CO_ {3 (водн)} + H_2O _ {(l)} \]
Металлоиды
Промежуточные свойства между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
Металлоиды используются в полупроводниковой промышленности.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Физические свойства металлоидов
- Состояние : Все они твердые при комнатной температуре.

- Проводимость : Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при правильных условиях, поэтому их называют полупроводниками.
Блеск : Кремний , например, выглядит блестящим, но не является ковким или пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.
- Твердые растворы : Они могут образовывать сплавы с другими металлами.
Химические свойства металлоидов
- Их физические свойства, как правило, металлические, но их химические свойства, как правило, неметаллические.
- Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлических и неметаллических свойствах
Металлический символ является самым сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению на при перемещении вправо в любой период (неметаллический характер увеличивается с увеличением значений ионизации). Внутри любой группы элементов (столбцов), , металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере движения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами .
Внутри любой группы элементов (столбцов), , металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере движения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами .
Авторы и авторство
.7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции в изменении металлических и неметаллических характеристик Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий жидкий).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле. - Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения.
 Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), а также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1. {-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами обычно имеют ионную природу . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h4O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h4O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + h4O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (водн. ) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h4O (l)} \ nonumber \]
) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h4O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Электропроводность : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.

- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \ (\ ce {h4 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и превращаясь в анионы:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, который растворяется в воде с образованием кислот:
\ [\ ce {CO2 (г) + h4O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h4CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабую кислотность (углекислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + h4O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупким, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента этой группы может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере того, как мы перемещаемся вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
.9.2: Металлы и неметаллы и их ионы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество.Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).

- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга.Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
- Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества.
 Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками - Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения.Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, а обычно теряют электроны (т.е.е. окисляются ) когда они вступают в химические реакции реакции Обычно они не принимают электроны.
 {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.{-}} \ label {1.3} \ nonumber \]Соединения металлов с неметаллами имеют тенденцию быть ионными по природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h4O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h4O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою химическую природу основную , реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водный) \ rightarrow MgCl2 (водный) + h4O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (водный) \ rightarrow 2Al (NO3) 3 (водный) + 3h4O (l)} \ nonumber \]
.
Знакомьтесь — металлы! — MEL Science Blog
11 июня 2015г. , Timur Bulatov
Примерно 12 тысяч лет тому назад человек нашёл необычный камень, который плавился в огне, но не раскалывался. Этот камень оказался кусочком меди. Тот день был, возможно, самым важным в истории человечества. Так началась металлическая эра, которая продолжается и по сей день. Металлы окружают нас всюду, но знаем ли мы их истинную природу и причины их необыкновенных свойств?
{Graela: Fire Assay/ CC BY-NC-SA 2.0}
##Нужно копать глубже…
В химии есть золотое правило: причина любого свойства вещества кроется в его структуре. Металлы лишь подтверждают это, ведь их структура достаточно необычна. В твёрдых телах атомы металлов заряжены положительно (назовём их ионами) и связаны друг с другом отрицательно заряженными свободно движущимися электронами.
 Эти электроны не принадлежат ни одному атому – они обобществлены. Для лучшего понимания представьте себе «электронный газ». Такая система из положительных ионов, связанных обобществлёнными электронами, называется металлической связью.
Эти электроны не принадлежат ни одному атому – они обобществлены. Для лучшего понимания представьте себе «электронный газ». Такая система из положительных ионов, связанных обобществлёнными электронами, называется металлической связью.{ARTE: Модель металлической связи. Красным отмечены ионы металла, синим – электроны/ CC0}
Эта анимация отлично иллюстрирует металлическую связь:
Такая структура объясняет многие свойства металлов. Давайте рассмотрим некоторые из них подробнее.
##Металлический блеск
Металлы прекрасны прежде всего из-за их металлического блеска Именно поэтому с давних времён они используются в ювелирном деле. «Электронный газ», о котором мы говорили ранее, является причиной этого блеска. Свободно перемещающиеся электроны практически полностью отражают падающий свет, мы же воспринимаем это отражение как металлический блеск. Теперь, когда вы в следующий раз увидите прекрасное украшение, вы будете знать, почему оно так блестит!
{Serendipity Diamonds: Golden rings/ CC BY-ND 2.
 0}
0}Удивительный материал
{Barry: Forging/ CC BY-NC-SA 2.0}
Металлы зачастую пластичны. Только представьте: золотой самородок можно раскатать в лист толщиной 0,003 мм. Это возможно без разрыва металлической связи, потому что в процессе деформации свободные электроны связей сдвигаются вместе с ними. Хотя связи и сдвигаются, их очень трудно разорвать из-за их высоких энергий. Высокая энергия металлической связи также объясняет прочность металлов и их высокие температуры плавления и парообразования.
{Деформируемость металлов}
Пластичность и прочность делают металлы отличным материалом для кузнеца, ведь они ковки. Правда, при низких температурах ковкость может теряться, а металл — стать хрупким.
##Доставка тока на дом
Всем известно, что провода делают из металла, потому что металлы проводят ток. Электрическую проводимость можно объяснить с помощью теории металлической связи. Как мы уже знаем, в структуре металлов есть свободные подвижные электроны.
 После приложения даже небольшой разницы потенциалов эти электроны начинают перемещаться от отрицательного полюса к положительному, образуя электрический ток.
После приложения даже небольшой разницы потенциалов эти электроны начинают перемещаться от отрицательного полюса к положительному, образуя электрический ток.{arbyreed: Multi-line telephone cables/ CC BY-NC-SA 2.0}
##Металлы = магниты?
Мы знаем, что магниты притягивают металлические предметы. Однако, не каждый металл. Например, натрий не будет притягиваться магнитом. Дело в том, что большинство металлических предметов, которые мы используем в жизни, сделаны из железа, а оно ферромагнитно. Это значит, что ниже определённой температуры — значительно превышающей комнатную — у них появляется магнитный момент в отсутствие внешнего магнита в окружении. Этот магнитный момент является причиной притяжения металлов к постоянным магнитам. Магнитные свойства железа широко используются во многих сферах нашей жизни.
{Sarnil Prasad: Fridge magnets/ CC BY 2.0}
##Они всегда рядом
В периодической системе элементов Менделеева металлы составляют большинство: их 94 из 118 элементов.
 3% нашего тела приходится на металлы, но не волнуйтесь: детекторы в аэропорту на них не сработают! Люди используют более 1,5 миллиарда тонн металла ежегодно. Мы пользуемся металлами каждый день. Благодаря их замечательным свойствам, металлы необходимы и абсолютно незаменимы в нашей жизни.
3% нашего тела приходится на металлы, но не волнуйтесь: детекторы в аэропорту на них не сработают! Люди используют более 1,5 миллиарда тонн металла ежегодно. Мы пользуемся металлами каждый день. Благодаря их замечательным свойствам, металлы необходимы и абсолютно незаменимы в нашей жизни.Subscribe to our Twitter!
Follow @mel_science
Читайте также
Металл, все о металле, свойства металлов
Металл (название происходит от лат.  metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий.
metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий.Металлы — суть светлые тела, которые ковать можно. (Михаил Васильевич Ломоносов) Некоторые металлы Щелочные металлы: Литий, Натрий, Калий Щелочноземельные металлы: Бериллий, Магний, Кальций Переходные металлы: Железо, Платина Другие металлы: Алюминий, Свинец, Медь, Цинк Металлургия — совокупность связанных между собой отраслей и стадий производственного процесса от добычи сырья до выпуска готовой продукции — черных и цветных металлов и их сплавов. 
К черным металлам относят железо, марганец и хром. Все остальные — цветные. По физическим свойствам и назначению цветные металлы условно делят на тяжелые (медь, свинец, цинк, олово, никель) и легкие (алюминий, титан, магний).
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды черных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Исключением можно назвать около 16 элементов: т. н. благородные металлы (золото, серебро и др.), и некоторые другие (например, ртуть, медь), которые присутствуют без примесей. Золото, серебро и платина относятся также к драгоценным металлам.  Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).Характерные свойства металлов - Металлический блеск
- Хорошая электропроводность
- Возможность легкой механической обработки (например, пластичность)
- Высокая плотность
- Высокая температура плавления
- Большая теплопроводность
Физические свойства металла Все металлы (кроме ртути) тверды при нормальных условиях. Температуры плавления лежат в диапазоне от 39 °C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на легкие (плотность 0,53 ч 5 г/смі) и тяжелые (5 ч 22,5 г/смі). Металлы тонут Механические свойства металла Это способность металлов подвергаться различным способам механической обработки. 
Микроскопическое строение металла Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решетке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решетки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твердость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.). Из-за легкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов.
 Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твердых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешенные зоны, причем зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для ее полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течет электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придает металлам характерный блеск).

Применение металлов Конструкционные материалы Металлы и их сплавы — один их главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах. Электротехнические материалы Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.). Инструментальные материалы Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части).  В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.Урок химии в вечерней школе по теме «Физические свойства металлов»
Урок химии по теме «Физические свойства металлов» я провела в 9-м классе вечерней школы, учитывая контингент обучающихся. Это, в основном, ученики дневной школы, не желающие учиться, часто пропускающие занятия, переведённые по решению комиссии ПДН. Повысить интерес к уроку можно, убрав всё «лишнее», и чтобы урок имел практическую направленность.
Цель урока:
- Изучить свойства металлов как простых веществ на которых основано их применение.
- Научиться применять знания о металлах в повседневной жизни.
Девиз урока: Я! МОГУ! САМ!
План урока:
- Физические свойства металлов и применение металлов на основе их свойств.

- «Очумелые ручки».
- Задания для самостоятельной работы.
Ход урока
А что произойдёт, если вдруг изъять из употребления металлы, используемые в быту? Сколько мы испытаем трудностей и неудобств, если исчезнут одни только металлы? и далее рисую яркую картину применения металлов.
1. Простые вещества — металлы обладают рядом общих свойств: им присущ металлический блеск, ковкость, пластичность, высокая тепло- и электропроводность.
Физические свойства металлов объясняются особым строением кристаллической решётки (наличие свободных электронов) (рисунок №3)
а) агрегатное состояние — все твердые, исключение ртуть — единственно жидкий металл. Это его свойство нашло применение в градусниках для измерения температуры тела. При нагревании ртуть ,как жидкость , расширяется и поднимается вверх по трубочке в градуснике.
 По положению ртутного столбика мы определяем температуру тела. Чем выше температура тела, тем сильнее расширяется ртуть и, следовательно, выше поднимается ртутный столбик. Самый твёрдый – хром — режет стекло. Самые мягкие- калий, рубидий, цезий- легко режутся ножом.
По положению ртутного столбика мы определяем температуру тела. Чем выше температура тела, тем сильнее расширяется ртуть и, следовательно, выше поднимается ртутный столбик. Самый твёрдый – хром — режет стекло. Самые мягкие- калий, рубидий, цезий- легко режутся ножом.
б) высокая электропроводность — при нагревании уменьшается (колебание ионов- затрудняется движение электронов). Серебро, медь, золото, алюминий, железо (в порядке уменьшения).
в) высокая теплопроводность — закономерность та же. За счёт движения свободных электронов происходит быстрое выравнивание температуры в массе металла. Применение находит данное свойство при изготовлении печей для бани, при изготовлении радиаторов водяного отопления.
г) различная температура плавления – самая высокая температура плавления у вольфрама (3420) позволяет применять его при изготовлении спиралей для электрических ламп.

д) ковкость — изготовление различных изделий из железа в кузнице.
е) способность намагничиваться — железо, кобальт, никель. Находит применение при изготовлении магнитов.
ж) пластичность — способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку: золото, серебро, медь, алюминий. Из 1г золота можно вытянуть проволоку длиной 2 км.
Всем известна алюминиевая фольга. Алюминиевая фольга — это тонкий слой алюминия, в котором отлично сохраняются продукты питания, кофе, чай, лекарства, корма для домашних животных и многое другое.
Оловянная фольга, которая используется для заворачивания лучших сортов шоколада.
з) металлический блеск — хорошо отражают световые лучи. Золото отражает ультрафиолетовые лучи, используют в космонавтике, поэтому иллюминаторы скафандров космонавтов тонируют золотом.

Зеркало состоит из гладкого стекла, на которое наносят очень тонкий слой металла. Часто зеркала покрывают серебром, потому что оно прекрасно отражает свет.
2. «Очумелые ручки» (с демонстрацией опыта).
Почему человек познакомился вначале с золотом и серебром? — Человек познакомился с теми металлами, которые в природе встречаются в самородном виде.
- Золото-это драгоценный металл.
- Золото-это благородный металл.
- Золото-это редкий металл.
- Золото-это красивый металл.
- Золото-это царь металлов.
«Цыганское золото» — минерал пирит, который имеет такой же блеск и цвет, как и само золото. Его легко принять за самородок золота. Поэтому в народе говорят: «Не всё золото, что блестит». Золото не вступает в реакцию с другими веществами, которые с ним соприкасаются, поэтому и не меняет цвет со временем
Как почистиь «грязное» золото?
1.
 Золотые кольца и серьги будут блестеть сильнее, если подержать их в солёной воде.
Золотые кольца и серьги будут блестеть сильнее, если подержать их в солёной воде.2. Гладкое золотое колечко можно чистить губной помадой.
3. Чтобы вымыть золотые украшения , погрузите их в мыльную воду и осторожно протрите зубной щёткой.
Золото – мягкий металл, для придания твёрдости его сплавляют с медью.
Ювелирные изделия: проба 583 — в 1кг сплава содержится 583 г золота.
Как почистить « грязное» серебро?
Серебро со временем покрывается тёмным налётом и совсем не сверкает. В воздухе всегда есть немножко сернистых газов. Сернистые газы образуются при сгорании угля. Золото с ним не реагирует и остаётся чистым и сияющим. А серебро реагирует. Частички серебра соединяются с частичками сернистых газов, и получается тёмное вещество- сернистое серебро. Его можно счистить – и серебро засияет снова.
Что нужно сделать?
Возьми алюминиевую кастрюлю (или любую другую) и накроши туда обрезков обычной фольги.
 Её тоже делают из алюминия. Налей в кастрюлю воды, положи соды и тот серебряный предмет, который надо почистить . Прокипяти всё это. Предмет должен быть только из металла, серебра.
Её тоже делают из алюминия. Налей в кастрюлю воды, положи соды и тот серебряный предмет, который надо почистить . Прокипяти всё это. Предмет должен быть только из металла, серебра.Что должно произойти?
Тёмный налёт исчезнет, серебро заблестит как новенькое.
Почему?
Потому что частички соды вместе с частичками алюминия «отщипнут» серу от сернистого серебра. Остаётся одно серебро, а налёт исчезнет.
Серебро — металл , способный убивать микробы. Серебряные чаши, ложки, бокалы ценили в древности. Считалось, что люди, которые едят из серебряной посуды меньше болеют. Уже в наше время учёные точно установили, что частички серебра переходят из ложки или чашки в пищу и предохраняют от микробов- не пускают их в организм. Если погрузить в воду изделие из серебра на некоторое время , то мы получим «серебряную воду» или воду налить в серебряный сосуд, то получим «святую воду», так делают в церкви.
 И если на время поместить в такую воду семена, они быстрее прорастают, их всхожесть увеличивается. Срезанные цветы дольше стоят в «серебряной воде».
И если на время поместить в такую воду семена, они быстрее прорастают, их всхожесть увеличивается. Срезанные цветы дольше стоят в «серебряной воде».
«Химический» анекдот.
-Сыночек, вот тебе серебряная ложечка. Будешь класть её в стакан с чаем. Серебро убивает микробы.
-Так что же, я буду пить чай с дохлыми микробами?
3. Задания для самостоятельной работы.
2. Заполните таблицу.
Свойство металла
Примеры металлов, у которых свойство наиболее выражено
Область применения
Пластичность
Электропроводность
Теплопроводность
Металлический блеск
Твёрдость
Ковкость
3.
 Запишите признаки, по которым можно различить пластины, изготовленные:
Запишите признаки, по которым можно различить пластины, изготовленные:
а) из алюминия и меди
б) из свинца и алюминия
в) из серебра и графита4. Задание рисунок №1
5. Задание рисунок №2
Подведение итогов.
Чем был значим для вас учебный материал?
Как вы думаете, где в жизни могут пригодиться знания, которые вы получили при изучении этой темы?
Металлы — Химия
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
- 6 элементов в группе щелочных металлов,
- 6 в группе щёлочноземельных металлов,
- 38 в группе переходных металлов,
- 11 в группе лёгких металлов,
- 7 в группе полуметаллов,
- 14 в группе лантаноиды + лантан,
- 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
- вне определённых групп бериллий и магний.

Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия
Характерные свойства металлов
- Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
- Хорошая электропроводность
- Возможность лёгкой механической обработки
- Высокая плотность (обычно металлы тяжелее неметаллов)
- Высокая температура плавления (исключения: ртуть, галлий и щелочные металлы)
- Большая теплопроводность
- В реакциях чаще всего являются восстановителями.
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
 Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.
 003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием.
 Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины.
 Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы.
 При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
При взаимодействии с активными металлами вариантов реакций ещё больше:
Металлы и все о металлах от компании «Альфыа-СПК»
Металл — вещество, обладающее и сочетающее в себе такие качества, как: металлический блеск, ковкость, эластичность, теплопроводность, электропроводность, твердость, долговечность.

Металл это основное понятие, которое сочетает и несет в себе всю суть и важность металлургии, то есть металлы это обобщающее понятие семидесяти процентов периодической системы Д.И.Менделеева.
Общие и химические понятия
С точки зрения химии металлы характеризуют легкой отдачей электронов и образованием положительно заряженных ионов. В свободном состоянии металлы считаются восстановителями. Их способность к восстановлению неодинакова и определяется размещением в электрохимическом ряду. Разделение в электрохимическом ряду происходит в порядке их убывания и возможности к восстановлению окислительных свойств их ионов.
Металл
В быту человека металл имеет широкое применение и используется им как основа, оболочка или составляющие элементы всех продуктов человеческой жизнедеятельности. В наше время изучено и известно 85 элементов и соединений, относящихся к металлам.
Виды металлов складываются в несколько подгрупп:
1)черные: железо, сплавы на основе железа;
2) цветные: медь, алюминий, сплавы на основе меди и алюминия, олово, цинк, свинец, бронза, серебро, золото, магний и другие виды.

Сплавами металлов можно назвать сложные вещества, извлекаемые путем смешивания одного металла с другим, либо металла с неметаллическими элементами.
Основные свойства металлов и их понятияНаиболее значимые для человека свойства металлов:
Прочность – свойство металла и его сплавов не разрушаться и воспринимать воздействия внешних сил.
Твердость – свойство металла не поддаваться внедрению в него постороннего более твердого тела.
Ударная вязкость – сопротивление металла при ударе к разрушению, дроблению и расколу.
Ковкость – возможность подвергаться обработке и изменению формы при ударных нагрузках большой площади либо обработки давлением.
Жидкотекучесть – это свойство металла в жидком расплавленном виде заполнять форму по всем её частям и давать плотные отливки с точной формой матрицы.
Свариваемость – это свойство металла технологическое, означающее его способность при сварке образовывать крепкое сварное соединение, надежное в эксплуатации.
Податливость – это свойство металла получать правильные формы, размеры и шероховатость поверхности при обработке шлифующими и режущими инструментами.
Классификация и деление металлов в зависимости от температуры плавления
Легкосплавные – это металлы, температура плавления которых до 1539С. К таким металлам относят: ртуть 38,9 С°, галлий 29,78 С°, цезий 28,5 С° и т.д.
Тугоплавкие – это металлы, температура плавления которых более 1539С. К таким металлам относят: хром 1890С, молибден 2620С, и т.д.
Незаменимая часть истории. Благородные металлы.
На протяжении многих веков считалось, что металлы делятся на семь видов: золото, серебро, ртуть, медь, железо, олово, свинец. Серебро с золотом, не меняющиеся от воздействия высоких температур воздуха и влаги, были названы совершенными, благородными металлами. Металл, который от воздействия воздуха и воды теряет свои свойства, металлический блеск, покрываясь налетом, и при прокалке превращается в окалину, был обречен называться неблагородным и несовершенным.
Данное деление металлов применяется и по сей день, но с условием, что в процессе времени к золоту и серебру прибавились платина и четыре её сопутствующих вида: родий, палладий, осмий, иридий. Благородные металлы имеют очень маленькую долю от массы металлов всех видов. Обычно в природе они встречаются человеку в самородном виде. Небольшим исключением является серебро которое встречается как в виде самородков так и в виде соединений.
Очень интересен состав самородной платины. Так как платина содержит в себе около 20% железа и других металлов: родий, палладий, осмий, иридий, медь, никель, рутений. По подобию золота самородная платина разделяется на рассыпные и коренные месторождения. Коренное место рождение есть и в России и находится на Урале. Оно представляется монолитом Дунита это изверженная горная порода, состоящая из Fe и Mg с примесью железняка. В этом монолите и содержаться включения самородной платины в зерновом виде. Под воздействием внешних природных факторов монолитные породы превращаются в песок. Вода высвобождает зерновые включения платины и разносит её по долинам, оврагам, дну ручьев и рек. Именно таким образом происходит образования рассыпчатых месторождений платины. Добыча благородных металлов в промышленном масштабе происходит с помощью добычи полиметаллических руд, имеющих в составе малые количества серебра, золота, платины, палладия.
История благородных металлов является самой великой и интересной из исторических глав материальной культуры. Ведь именно с применения благородных металлов и имел свое зарождение и начало быт человечества. Много веков золото служило валютой для обмена. А из меди и бронзы делали первые орудия труда. Мало что изменилось и по сей день, сегодня из золота и серебра, как и тысячи лет назад, делают украшения. Золото является самой надежной фундаментальной валютой, которой поддерживают свой статус и страхуют себя все мировые государства.
Металл, видение астрологов и алхимиков
Металл — как символ космической энергии. Древние астрологи считали, что количество видов металлов не превышало числа планет и равнялось семи. Металлы в астрологическом понятии назывались «спрятанные в теле земли планеты». А уже в свою очередь, эти семь планетарных металлов образуют сплавы других. Они считали, что эти семь видов металлов характеризуют каждую из планет и группируются по восходящей прогрессии к Солнцу.
Расплавленный металл также является алхимическим символом. К примеру, ртуть – жидкий металл как состояние огня и воды.
Со слов древних астрологов и алхимиков, соответствие металлов по отношению к планетам исчисляется с высших к низшим: золото – Солнце, серебро – Луна, ртуть – Меркурий, Медь – Венера, железо – Марс, олово – Юпитер, свинец – Сатурн. При этом древние считали и ассоциировали производство металла с адским огнем, а с другой стороны процесс его выплавки это очищение огнем.
Культурное значение металлаМеталл – это слово, как и непосредственно сам материал сыграли очень большую роль и дали очень большой потенциал развитию и образованию мировой культуры и её видов.
За всю историю мировой культуры было написано множество литературных произведений, сыграно огромное количество спектаклей, снято множество кинофильмов, упомянуто в различных религиозных писаниях, культурных направлениях. Основу всему этому составу, точкой отрыва послужил именно металл.
Существует даже музыкальное направление, именованное как «металл». Представители этого направления назвали его таким из-за мелодичности звучания инструментов в своих произведениях. Присущим этим произведениям жесткость и тяжесть, ритмичность игры на инструментах схожа с работой кузнецов. Металлисты даже создали свой стиль одежды. В его состав входят жесткие формы. Одежда выполнена из грубой кожи и в основном черного цвета. Декорирование одежды делается при помощи блестящих хромированных металлических вставок, кнопок, колец, цепей, цвет и блеск которых не оставляет равнодушным ни одного человека и символизирует собой металл.
Основные ассоциации со словом металл
У большинства людей слово металл ассоциируется со словом железо. Что же такое железо?
Железо – это металл, ковкий, серебристо-белого цвета, имеет высокую химическую реакционную способность: оно быстро коррозирует при воздействии высоких температур или при повышенной влажности воздуха. Железом обычно именуют его сплавы с содержанием примесей не более 0,8%, которые дают ему возможность сохранять мягкость и пластичность. В промышленности сплавы железа содержат в себе углерод: в стали до 2,14% в чугуне до 6,67% углерода. Специфические свойства железа делают его самым важным для быта человека. В природе железо очень редко встречается в чистом виде. Распространенность железа в земной коре занимает четвертое место среди металлов. Так же считается, что земное ядро в основном состоит из железа. На производство железа направленно 95% производственного комплекса земли. Такая доля характеризуется широтой применения железа в быту человека.
Металлический блеск стальных конструкций Статьи
« НазадМеталлический блеск стальных конструкций 15.10.2017 10:43 Краски с металлическим эффектом придают конструкциям более привлекательный и современный вид. Они создают образ новизны и высокого качества, одновременно подчеркивая индивидуальность и дизайн изделия.Например, декоративная окраска полос краской с металлическим эффектом придаст изделиям несколько изысканных штрихов. Такой краской окрашивают автомобили и другие транспортные средства, мебель и всевозможные изделия из металла. В строительстве краски с металлическим эффектом используют для придания стальным конструкциям, колоннам и другим элементам здания эффектного внешнего вида.
Краски с металлическим эффектом в течение долгого времени использовались в машиностроении, а позже — для внутренней отделки больших судов для круизов. Практика их применения распространилась из этих отраслей промышленности и в строительство.
В 1970-х годах были проведены первые испытания новых лакокрасочных материалов. Тогда при отделке использовали молотковый эффект. По-настоящему широкое применение в строительной индустрии краски типа «металлик» нашли только в 90-е годы. Сейчас они все чаще используются для отделки зданий, например в Хельсинки — здания Саноматало, принадлежащего Финской издательской группе Санома-ВСОУ, а также различных торговых центров в центральных районах города. В настоящее время фасады, окрашенные красками типа «металлик», во многих случаях используют наряду со стеклянными фасадами, особенно в муниципальных зданиях.При планировании строительства здания рассмотрите вопрос подбора материалов с нескольких позиций. Для того чтобы строительство было успешным, надо принять в расчет и поведение каждого материала в отдельности, и то, как они будут взаимодействовать; важно также «почувствовать» материал. Для каждого элемента здания надо продумать индивидуальное решение, чтобы не только обеспечить функциональность и долгий срок службы, но и создать неповторимую атмосферу индивидуальности самого здания.
Петер Огард — архитектор и разработчик здания торгового центра Исо Омена. Он делит все материалы на «живые» и «мертвые» по их воздействию на восприятие. Он говорит, что краска с металлическим эффектом оживляет кажущуюся мертвой стальную поверхность и делает конструкцию запоминающейся.
Каарина Лофстром, архитектор и глава компании «Арккитехти-тоймисто Каарина Лофстром Ои», использовала краски «металлик» компании «Тиккурила» для отделки современного Биоцентра в Университете Хельсинки, Центра исследований и научных технологий Иннополи и части Парка технологии Отаниеми в Эспоо. Принцип, лежащий в основе всех ее проектов, заключается в том, что новое здание должно органично вписываться в ландшафт той местности, где его предполагается строить. Для нее важно попытаться создать то, что неподвластно времени, соединяя при этом традиции и новации. Это, однако, не исключает применения новомодных решений.
Создание цветового дизайна здания и подбор гармоничных цветов требуют опытного подхода. Петер Огард утверждает, что это довольно трудная работа. Для того чтобы облегчить проблему выбора цвета, «Тиккурила» предоставляет специальные образцы накрасок на различных подложках. Кроме того, предлагаются материалы, предназначенные для антикоррозионной защиты и создания специальных эффектов.
Лакокрасочные материалы с эффектом «металлик»
Fontecryl 50 акриловая водоразбавляемая краска для полуглянцевых покрытий Temadur 50 полиуретановая краска для полуглянцевых покрытий Temadur 90 полиуретановая краска для глянцевых покрытий Temadur HB 50 полиуретановая краска с антикоррозиоными пигментами для полуглянцевых покрытий Temalac AB 70 алкидная краска для высокоглянцевых покрытий Temalac FD 80 алкидная краска для быстросохнущих высокоглянцевых покрытий Temalux 70 краска на основе сложного эфира этиленоксида для высокоглянцевых покрытий Diccodur 40 полиуретановая краска для полуглянцевых покрытий по древесине 2.11 Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Физические свойства металлоидов
- Химические свойства Металлоиды
- Тенденции в металлических и неметаллических свойствах
- Участники
Навыки для развития
- Чтобы понять основные свойства, отделяющие металлы от нементалов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Таблица 2.11.1 : Характерные свойства металлических и неметаллических элементов: Металлические элементы
Неметаллические элементы
Отличительный блеск (блеск)
Бесцветный, разные цвета
Податливый и пластичный (гибкий) в твердом виде
Хрупкое, твердое или мягкое
Проводить тепло и электричество
Плохие проводники
Оксиды металлов основные, ионные
Неметаллические оксиды кислые, соединения
Катионы в водном растворе
Анионы, оксианионы в водном растворе
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга (кусок золота в виде кубика сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле).
- Пластичность: Металлы можно втягивать в проволоку. Из 100 граммов серебра можно сделать тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения. Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы обычно имеют низкую энергию ионизации, а обычно теряет электроны (т.е.- \]
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не имеют очевидной закономерности, 2 + является обычным, и 1 + и 3 + также наблюдаются
- Соединения металлов с неметаллами имеют тенденцию быть ионными по природе
- Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
Na 2 O ( s ) + H 2 O ( l ) -> 2NaOH ( водн. )
CaO ( с ) + H 2 O ( л ) -> Ca (OH) 2 ( водн. )
- Оксиды металлов проявляют свою химическую природу основную за счет реакции с кислотами с образованием солей и воды:
Оксид металла + кислота -> соль + вода
MgO ( с ) + HCl ( водн. ) -> MgCl 2 ( водн. ) + H 2 O ( l )
NiO ( s ) + H 2 SO 4 ( водн. ) -> NiSO 4 ( водн. ) + H 2 O ( l )
Пример
Какова химическая формула оксида алюминия?
Решение
Al имеет заряд 3+, ион оксида — O 2-, таким образом, Al 2 O 3
Пример
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
Al 2 O 3 ( s ) + 6HNO 3 ( водн. ) -> 2Al (NO 3 ) 3 ( водн. )
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод).
- Не податливые и ковкие : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Электропроводность : Плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов
- Семь неметаллов существуют в стандартных условиях как двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- Ф 2 ( г )
- Класс 2 ( г )
- Br 2 ( л )
- I 2 ( л ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.Они имеют электроотрицательный характер.
- Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
Неметалл + металл -> Соль
\ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {углекислота}} {H_2CO_ {3 (водн.)}} \]
(газированная вода слабокислая)
- Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\ [CO_ {2 (г)} + 2NaOH _ {(водн.)} \ Rightarrow Na_2CO_ {3 (водн.)} + H_2O _ {(l)} \]
Металлоиды
Промежуточные свойства между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Утюг Азот Сурьма Меркурий Сера Германий цинк фосфор Физические свойства металлоидов
- Состояние : Все они твердые при комнатной температуре.
- Проводимость : Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при определенных условиях, поэтому их называют полупроводниками.
Блеск : Кремний , например, выглядит блестящим, но не является ковким или пластичным (это хрупкий — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.
- Твердые растворы : они могут образовывать сплавы с другими металлами.
Химические свойства металлоидов
- Их физические свойства, как правило, металлические, но их химические свойства, как правило, неметаллические.
- Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлическом и неметаллическом характере
Металлический символ — самый сильный для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению при перемещении вправо в любой период (неметаллический характер увеличивается с увеличением значений ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается у переходных металлов .
Почему металлы блестят? — Chemistry LibreTexts
Мы видим вещи, потому что фотоны попадают в заднюю часть нашей сетчатки и поглощаются специализированными молекулами (белками и связанными с ними молекулами пигмента).Это приводит к изменениям в структуре белка и запускает каскад нейронных клеточных событий, которые изменяют активность мозга. Так откуда берутся эти фотоны? Прежде всего, они могут излучаться от источника (Солнца, лампочки и т. Д.), Который кажется сияющим и видимым в темноте. В качестве альтернативы фотоны могут отражаться от поверхности; на самом деле большинство вещей, которые мы видим, не излучают свет, а скорее отражают его. Красная футболка кажется красной, потому что она поглощает другие цвета и отражает красный свет.Фотоны также могут преломляться, когда проходят через вещество. Ограненный алмаз сверкает, потому что свет преломляется, когда проходит через материал и выходит из множества граней. Преломление возникает, когда фотоны сталкиваются с электронами, поглощаются, а затем (очень скоро после этого) повторно излучаются при прохождении через материал. Эти процессы требуют времени, поэтому видимая скорость света замедляется. Фотону может потребоваться много тысяч лет, чтобы переместиться от ядра к поверхности Солнца из-за всех столкновений, которые он совершает во время путешествия. 68
Чтобы объяснить, почему металлы (и графит) блестят, мы используем комбинацию отражения, преломления и уровней энергии МО. Когда фотон света поглощается и переизлучается, электрон перемещается с одной орбитали на другую. Рассмотрим кусок металла при комнатной температуре. Когда фотон попадает на поверхность металла, он сталкивается с почти непрерывной полосой МО. Большинство фотонов, независимо от их длины волны, могут быть поглощены, потому что существует энергетический зазор между орбиталями, соответствующий энергии фотона.Этот процесс продвигает электроны на более высокий энергетический уровень. Когда электроны опускаются обратно на более низкий уровень энергии, фотоны переизлучаются, что приводит к характерному металлическому блеску. Металлы на самом деле излучают свет, хотя это не означает, что металлы светятся в темноте (как лампочка или Солнце). Вместо этого металлы поглощают и переизлучают фотоны даже при комнатной температуре.
Цвет конкретного металла зависит от диапазона длин волн, которые повторно излучаются. Для большинства металлов переизлучаемые фотоны имеют широкий диапазон длин волн, что делает металлическую поверхность серебристой.Некоторые металлы, такие как медь и золото, поглощают свет в синей области и повторно излучают свет с длинами волн, которые смещены в сторону красного конца спектра (400–700 нм), и поэтому они кажутся желтоватыми. Это связано с релятивистскими эффектами, выходящими за рамки этой книги, но это то, чего стоит ожидать в ваших будущих исследованиях по физической химии!
Теперь мы также можем понять, почему металлы излучают свет при нагревании. Кинетическая энергия атомов увеличивается с повышением температуры, что способствует перемещению электронов с орбиталей с низкой энергией на более высокие.Когда эти электроны теряют эту энергию, возвращаясь в основное состояние, они излучаются в виде света. Чем выше температура, тем короче длина волны излучаемого света. Когда нить нагревается, она сначала светится красным, а затем становится все белее по мере того, как излучаются фотоны с все большим числом длин волн.
Эта глава привела нас к тому моменту, когда мы должны иметь довольно хорошее представление о типах взаимодействий, которые могут происходить между атомами одного и того же элемента. Мы видели, что свойства различных элементов можно объяснить, рассматривая структуру их атомов и, в частности, то, как ведут себя их электроны, когда атомы взаимодействуют с образованием молекул или больших скоплений атомов (например, алмаза.) Что мы еще не рассмотрели, так это то, как атомы разных элементов взаимодействуют с образованием соединений (веществ, которые имеют более одного элемента). В главе 4 мы рассмотрим этот вопрос и многое другое.
Вопросы к ответу
1. Какие свойства указывают на то, что вещество является металлическим?
2. Почему металлы блестят?
3. Как можно объяснить металлические свойства атомно-молекулярной структурой Al (например)?
4. Почему мы можем видеть сквозь алмаз, а не алюминий? А как насчет графита?
5.Почему алюминий (и в этом отношении все металлы) проводят электричество? Что должно происходить в атомно-молекулярном масштабе, чтобы это произошло?
6. Что тот факт, что алмаз не проводит электричество, говорит вам о связи в алмазе?
7. Как модели связывания алмаза и графита объясняют различия в свойствах алмаза, графита и такого металла, как алюминий?
8. Почему можно использовать разные модели для описания сцепления у разных видов?
Список литературы
68 Роберт Нэй (1998).Глазами Хаббла: рождение, жизнь и насильственная смерть звезд. CRC Press. ISBN 0750304847. Конечно, возникает вопрос, это тот же фотон?
Светоотражающие качества минерала.
Блеск кварца и турмалина: Кварц и турмалин обычно имеют стекловидный блеск, если вы исследуете их кристаллические грани или поверхности раковинных изломов. Кристаллы турмалина на этой фотографии имеют интересный блеск. Параллельные полосы на их поверхности придают им шелковистый блеск, что может быть неожиданным.Правообладатель иллюстрации iStockphoto / halock.
Что такое блеск?
Блеск — это слово, используемое для описания светоотражающих характеристик образца минерала. Блеск экземпляра обычно передается одним словом. Это слово описывает общий вид поверхности образца в отраженном свете.
Одиннадцать прилагательных обычно используются для описания минерального блеска. Они бывают металлическими, субметаллическими, неметаллическими, стекловидными, матовыми, жирными, жемчужными, смолистыми, шелковистыми, восковыми и адамантиновыми.Эти прилагательные передают одним словом свойство, которое может иметь важное значение при идентификации минерала.
От блеска материала также зависит, как он будет использоваться в промышленности. Например, производители ювелирных изделий не стали бы крупнейшими потребителями золота, если бы металл имел непривлекательный блеск. Перламутровый блеск мусковита делает молотый мусковит обычным ингредиентом косметики.
Содержание
Как соблюдать блеск
Блеск минерала лучше всего наблюдается на поверхности, свободной от влаги, грязи, потускнения и истирания.Геологи в полевых условиях обычно носят с собой каменный молот, чтобы разбивать камни, чтобы можно было наблюдать их истинный блеск и цвет. Обычно в поломке нет необходимости при наблюдении за блеском очищенных и ухоженных образцов в лаборатории или классе.
Блеск лучше всего виден при прямом освещении. Это позволяет свету, падающему на образец, отражаться в глазах наблюдателя. Правильный осмотр включает перемещение образца (или источника света, или головы наблюдателя) под разными углами для наблюдения полного характера блеска.
Типы блеска
Фотографии и описания на этой странице иллюстрируют некоторые из наиболее распространенных блеска минералов.
Серебряный металлический блеск в галените: На этой фотографии показан серебряный металлический блеск красивого кубического кристалла галенита. Кристалл галенита составляет около двух дюймов со стороны, а соседние белые кристаллы представляют собой кальцит. Собран в шахте Свитуотер, округ Рейнольдс, штат Миссури. Образец и фото Arkenstone / www.iRocks.com.
Металлический глянец
Образцы с металлическим блеском обладают отражательной способностью и яркостью металла и всегда непрозрачны. Чем более гладкая поверхность, тем ярче их блеск и тем выше их отражательная способность.
Когда луч падающего света отражается от идеально гладкой отражающей поверхности, угол отражения равен углу падения. Гладкие поверхности имеют более высокий блеск, потому что весь падающий на них свет имеет возможность отражаться.Однако, когда свет падает на шероховатую поверхность, большая часть света попадает на неровности поверхности. Этот свет рассеивается во многих направлениях. Эти образцы с неровной поверхностью будут иметь меньший блеск, чем образцы с гладкой поверхностью.
Большинство металлических минералов имеют цвет, подобный самородным металлам, таким как золото, серебро или медь. Тот факт, что образец обладает высокой отражающей способностью, не придает ему металлического блеска. Он также должен быть непрозрачным и иметь цвет металла.
Непрозрачность — важная составляющая металлического блеска. Свет проникает в прозрачные или полупрозрачные образцы. Когда образец непрозрачен, весь падающий свет имеет возможность отражаться.
Многие сульфидные и сульфосоли имеют металлический блеск, например пирит, галенит, халькопирит и пирротин. Некоторые оксидные минералы, такие как гематит, рутил, магнетит и касситерит, могут иметь металлический блеск.
Субметаллический блеск в магнетите: Образец магнетита (разновидность: магнетит) с субметаллическим блеском.Образец привлек множество мельчайших частиц железа. Этот образец имеет диаметр примерно 10 сантиметров.
Субметаллический глянец
Некоторые образцы обладают блеском, который нельзя назвать «металлическим» или заставляет наблюдателя сомневаться в использовании этого прилагательного. Для этих образцов можно использовать слово «субметаллический».
Эти образцы обычно непрозрачны и часто имеют черный цвет. Другие имеют мелкий размер зерна или неровную или ямчатую поверхность, которая мешает отражению падающего света.
Наблюдатели должны быть осторожны, потому что потускнение иногда может ввести их в заблуждение, решив, что образец субметаллический, а не металлический или неметаллический. Именно тогда становятся важными наблюдения за блеском на только что сломанной поверхности.
Гематит, магнетит, графит и хромит являются примерами минералов, которые могут иметь субметаллический блеск.
Неметаллический глянец
Большинство образцов минералов не имеют металлического или субметаллического блеска.Говорят, что эти образцы имеют «неметаллический» блеск. Существует множество разновидностей неметаллических люстр, наиболее распространенные из которых описаны ниже.
Примечание: Название «неметаллический» относится к блеску этих минералов и не имеет ничего общего с их элементным составом.
Неметаллический (стекловидный или стекловидный) блеск апатита: Эти маленькие зеленовато-желтые кристаллы апатита обладают стекловидным блеском. Стекловидный означает «внешний вид стекла».Некоторые люди назвали бы это «стеклянным» блеском, и это было бы совершенно правильно. Кристаллы апатита происходят из Серро-дель-Меркадо, Дуранго, Мексика, и в основном они имеют длину около 8 миллиметров. Правообладатель иллюстрации Geology.com.
Стекловидный блеск
Образцы со стекловидным блеском имеют отражающий вид, похожий на стекло. Этот блеск иногда называют «стеклянным». Многие образцы апатита, берилла, флюорита и кварца имеют стекловидный блеск.Некоторые образцы кальцита имеют стекловидный блеск на поверхности скола.
Стекловидное тело — самый распространенный тип глянца. Около 70% всех минералов могут иметь стекловидный блеск.
Тусклый (или землистый) блеск: Образец массивного гематита, который не светится и имеет тусклый или землистый блеск. Он имеет диаметр около четырех дюймов (десять сантиметров) и был собран недалеко от Антверпена, штат Нью-Йорк.
Тусклый блеск
Образцы с тусклым блеском, иногда описываемым как «землистый» блеск, не являются отражающими.У них шероховатая, пористая или зернистая поверхность, которая рассеивает свет, а не отражает свет. Каолинит, лимонит и некоторые образцы гематита имеют тусклый или землистый блеск.
Greasy Lustre: Кабошон из серпантина лаймового цвета с чудесным зеленым цветом и жирным блеском.
Жирный блеск
Образцы с жирным блеском кажутся покрытыми тонким слоем масла или жира. Некоторые образцы змеевика, нефрита, алмаза, везувианита и нефелина имеют маслянистый блеск.
Перламутровый (или перламутровый) блеск: Жемчуг и перламутр (внутренний слой некоторых раковин моллюсков) имеют перламутровый или перламутровый блеск. Правообладатель иллюстрации iStockphoto / barbaraaaa.
Перламутровый блеск
Образцы с жемчужным блеском (иногда называемым перламутровым блеском) имеют поверхность с отражающей способностью, аналогичную жемчужной.
Этот вид часто возникает на поверхностях скола прозрачных или полупрозрачных минералов, которые включают некоторые слюды, некоторые полевые шпаты и некоторые карбонатные минералы.Примеры включают мусковит, ортоклаз и кальцит.
В этих минералах свет проникает в минерал и отражается от множества атомных плоскостей под поверхностью. Это может вызвать расфокусированное свечение света, выходящего из небольших глубин внутри образца.
Смолистый блеск: Кусочки балтийского янтаря от желтого до оранжевого цвета со смолистым блеском. Правообладатель иллюстрации iStockphoto / IGraDesign.
Смолистый глянец
Название «смолистый» относится к внешнему виду смолы, выделяемой хвойными деревьями.Янтарь, сфалерит, альмандиновый гранат и некоторые образцы серы имеют смолистый блеск. Образцы со смолистым блеском обычно имеют желтый, оранжевый, красный или коричневый цвет.
Шелковистый блеск: Образец атласного гипса с отражающей волокнистой структурой, создающей шелковистый блеск. Правообладатель иллюстрации iStockphoto / Джоэл Папалини.
Шелковистый блеск
Некоторые образцы минералов состоят из множества параллельных волокон или параллельных кристаллов, которые связаны вместе и отражают свет.Это дает блеск, похожий на свет, отраженный от пучка параллельных шелковых нитей.
Гипс из атласного лонжерона является прекрасным примером шелковистого блеска. Тигровый глаз, хризотил (змеевик), тремолит и улексит также могут иметь шелковистый блеск.
Кристаллы турмалина на первом изображении вверху страницы имеют шелковистый блеск, создаваемый параллельными полосами на призматических кристаллах.
Восковый блеск: Три кабошона из различных типов змеевика, которые создают восковой блеск на их полированных поверхностях.Полироль не яркий. Вместо этого это мягкое свечение.
Восковый блеск
Материалы с восковым блеском имеют внешний вид, похожий на поверхность свечи, блока пчелиного воска или куска парафина. Некоторые образцы талька, змеевика, грубого опала, нефрита и раковинные изломы агата являются примерами материалов с восковым блеском.
Материалы с восковым блеском обычно полупрозрачны, и прямой свет на них создает мягкое восковое свечение.
Адамантиновый блеск: Восьмигранный кристалл алмаза с положительным рельефом на поверхности вмещающей породы. Адамантин — высшая степень блеска. Этот кристалл алмаза оценивается примерно в 1,5 карата и добывается на шахте Удачная, Якутия, Сибирь, Россия. Образец и фото Arkenstone / www.iRocks.com.
Адамантиновый блеск
Адамантин — самый высокий блеск среди минералов. Этот блеск похож на стекловидное тело, но образцы адамантина обладают большей отражающей способностью.Нет резкого разделения между стекловидным блеском и адамантиновым блеском. Когда образец имеет блеск, который трудно отнести к одной из этих категорий, может подойти термин субадамантин.
Некоторые образцы алмаза, касситерита, корунда, сфалерита, церуссита, ванадинита, титанита, малахита, рутила и циркона имеют адамантиновый блеск.
Коммерческое использование блеска
Многие минералы, используемые в коммерческих продуктах, обязаны своей ценностью и популярностью, по крайней мере частично, их блеску.Лучший пример — золото. Он имеет металлический блеск с высокой отражающей способностью и устойчив к потускнению. Этот красивый блеск делает золото идеальным металлом для изготовления ювелирных изделий. Сегодня большая часть золота в мире производится в ювелирных изделиях.
Мусковитовая слюда — еще один минерал, который используется в коммерческих целях из-за его блеска. Его блестящий, привлекательный жемчужный блеск, а также способность измельчаться в крошечные плоские хлопья делают его идеальной добавкой в самые разные продукты.Мельчайшие хлопья мусковита придают блеск косметике, краскам, штукатурке, пластику, плитке, глазури для керамики и многим другим продуктам, которые люди используют или видят каждый день.
Блеск не является диагностическим
Блеск не является диагностическим свойством. Это означает, что для большинства видов минералов блеск может варьироваться от одного образца к другому.
Например: гематит может иметь металлический блеск, субметаллический блеск или тусклый блеск. Один экземпляр может демонстрировать один или несколько из этих блесков.
Из-за этого нельзя сильно полагаться на блеск при идентификации минералов. Это можно рассматривать как «подсказку», которая может указать человеку правильный путь.
Взгляд геммолога на блеск
Большинство геологов, включая автора этой статьи, не так глубоко задумывались о блеске, как геммологи. Если вы откроете почти любой учебник минералогии на страницах, описывающих минерал, блеск обычно выражается одним или двумя прилагательными, перечисленными выше.Например: от субметаллического до металлического.
Автор завершил курсовую работу для получения диплома аспиранта геммолога в Геммологическом институте Америки в 2018 году. Во время прохождения курсов он понял, что геммологи прилагают больше усилий для оценки блеска. Они также используют блеск для идентификации драгоценных камней в большем количестве способов, чем геологи для идентификации минералов. Геммолог может сообщить:
В корунде базальные плоскости разделения могут иметь жемчужный или субметаллический блеск.Это отличается от стекловидного до адамантинового блеска, который может наблюдаться на гранях кристалла и излома. Перламутровый блеск на плоскостях разъема может указывать на то, что материал может проявлять астеризм, если его правильно разрезать.
Геммологи обращают внимание на блеск, потому что после цвета блеск является наиболее очевидным свойством предмета, который будет продаваться за десятки, сотни, тысячи или миллионы долларов.
Вот проблема: вы изучаете кабошон (драгоценный камень в форме купола), вырезанный из материала, который может быть зеленым кварцем, хризопразом (зеленым халцедоном) или окрашенным кварцитом.Вы знаете, что под микроскопом (или ручным объективом) край, где плоский низ кабошона встречается с куполообразным верхом, часто имеет по крайней мере один крошечный скол. Вы находите скол конхоидальной формы. Как вы сможете определить, сделан ли кабошон из зеленого кварца, хризопраза или кварцита?
Ответ кроется в блеске поверхности чипа. Эти три материала имеют характерный блеск излома. Зеленый кварц будет стекловидным, хризопраз будет тусклым до воскообразного, а кварцит будет зернистым.
Проблема выше была простой. Этот материал мог быть одним из множества драгоценных материалов помимо кварца, халцедона и кварцита. Это могли быть жадеит, нефрит, идокраз (везувианит), серпентин, амазонит, празиолит, апатит, гелиодор, малахит, турмалин, диопсид, флюорит, зеленый гранат, гаспеит, изумруд, зеленый берилл, кианит, мауситит, молдавит, опал, перидот, авантюрин, сфен, сподумен, эпидот, варисцит, цоизит или другой менее распространенный драгоценный камень.Один взгляд на блеск может устранить большинство зеленых драгоценных камней в этом списке.
Геммологи тоже озабочены явлениями. Это вещи, которые драгоценные камни делают с светом, выходящим за рамки простого блеска, например: адваресценция, авантюресценция, радужность, лабрадоресценция, опалесценция, игра цвета и огонь. Если они не связаны с блеском, их будет трудно отделить от него.
В заключение мы расскажем о блеске, известном как «жемчужный». Есть много видов жемчуга, которые производят разные виды организмов, которые живут в разных частях света, в разных типах воды.Геммологи, специализирующиеся на жемчуге, могут провести целые курсы по жемчужному блеску.
Найдите другие темы на Geology.com:
Скалы: Галереи фотографий вулканических, осадочных и метаморфических пород с описаниями. Минералы: Информация о рудных минералах, драгоценных камнях и породообразующих минералах. Вулканы: Статьи о вулканах, вулканических опасностях и извержениях прошлого и настоящего. Драгоценные камни: Яркие изображения и статьи об алмазах и цветных камнях. Общая геология: Статьи о гейзерах, маарах, дельтах, перекатах, соляных куполах, воде и многом другом! Geology Store: Молотки, полевые сумки, ручные линзы, карты, книги, кирки твердости, золотые кастрюли. Алмазы: Узнайте о свойствах алмаза, его разнообразных применениях и открытиях. Блеск минералов
Минералы можно разделить на категории в зависимости от того, являются ли они непрозрачными или прозрачными . Тонкий срез непрозрачного минерала, такого как металл, не будет пропускать свет, тогда как тонкий срез прозрачного минерала будет.
Показатель абсорбции непрозрачного минерала высокий. Свет, падающий на непрозрачный минерал, такой как металл, не может распространяться через минерал из-за такой высокой скорости поглощения и, таким образом, будет отражаться. Непрозрачные минералы обычно отражают от 20% до 50% или более падающего на них света. Напротив, большая часть света, падающего на прозрачный минерал, проходит внутрь и через минерал; прозрачные минералы могут отражать от 5% падающего света до 20%.Обычно те минералы, которые обладают металлической связью, непрозрачны, тогда как минералы, в которых преобладает ионная связь, прозрачны.
Относительные различия в непрозрачности и прозрачности описываются как блеск . Термин блеск относится к количеству и качеству света, который отражается от внешних поверхностей минерала. Блеск позволяет оценить, насколько «блестит» поверхность минерала. Это качество определяется типом атомных связей, присутствующих в веществе.Это связано с показателями поглощения и преломления материала и количеством дисперсии кристаллической решетки, а также текстурой обнаженной поверхности минерала.
Минералы в основном делятся на две категории: металлический, и неметаллический , блеск. Минералы, обладающие металлическим блеском, непрозрачны, обладают высокой отражающей способностью и высоким коэффициентом поглощения. Этот тип блеска указывает на наличие металлических связей в кристаллической решетке материала.Примерами минералов с металлическим блеском являются самородная медь, золото и серебро, галенит, пирит и халькопирит. Блеск минерала, не обладающего металлическим блеском, называют субметаллическим ; гематит является примером субметаллического блеска. Свойство штриха может помочь определить, имеет ли образец металлический или неметаллический блеск. Металлы имеют тенденцию быть мягкими, что означает, что из образца полосы металла может быть получено больше порошкообразного материала, чем из неметалла.Металлы также непрозрачны, не пропускают свет. Поэтому минералы, которые обладают металлическим блеском, имеют тенденцию демонстрировать толстую, плотную, темную полосу, тогда как минералы, обладающие неметаллическим блеском, имеют тенденцию давать более тонкую, менее плотную полосу, которая также имеет более светлый цвет.Такие прилагательные, как «стекловидный», «тусклый», «жемчужный», «жирный», «шелковистый» или «адамантин» часто используются для описания различных типов неметаллического блеска.
- Тусклый или Землистый
Минералы тусклого или землистого блеска очень плохо отражают свет и не светятся.Этот тип блеска часто наблюдается у минералов, которые состоят из совокупности крошечных зерен.
- Смолистые
Поверхность из смолистого блеска имеет блеск, напоминающий смолу. Такие материалы имеют показатель преломления более 2,0. Сфалерит (ZnS) имеет смолистый блеск.
- Перламутровый
Перламутровый блеск кажется переливающимся, опалесцирующим или перламутровым. Обычно это проявляется на минеральных поверхностях, параллельных плоскостям идеального скола.Слоистые силикаты, такие как тальк, часто демонстрируют жемчужный блеск на поверхностях скола.
- Жирный
Поверхность с жирным блеском кажется покрытой тонким слоем масла. Светорассеивающая поверхность, слегка шероховатая, например, нефелина, может иметь жирный блеск.
- Шелковистый
Шелковистый блеск возникает, когда свет отражается от совокупности тонких параллельных волокон; И малахит, и змеевик могут иметь шелковистый блеск.
- Стекловидное тело
Стекловидный блеск возникает у минералов с преобладающей ионной связью и напоминает отражательную способность битого стекла. Показатель преломления таких минералов составляет от 1,5 до 2,0. Многие силикаты обладают таким блеском; кварц и турмелин демонстрируют стекловидный блеск.
- Адамантин или блестящий
Блестящий блеск, такой как сверкающее отражение алмаза, известен как адамантин.Минералы с адамантиновым блеском обладают высокими показателями преломления (1,9–2,6), обладают высокой дисперсностью и полупрозрачностью. Ковалентная связь или присутствие атомов тяжелых металлов или переходных элементов может привести к адамантиновому блеску.
Металлическое склеивание | Химия для неосновных специалистов
- Определите металлическую связку.
- Опишите свойства металлов.
Почему металлы ведут себя именно так?
На изображении выше изображена медная пластина, изготовленная в 1893 году.Посуда очень искусно украшена и очень полезна. Что бы произошло, если бы мы решили, что хлорид меди (I) был таким же хорошим материалом (ну, в нем есть медь). CuCl превратился бы в порошок, когда мы его растолкали, чтобы придать ему форму. Металлы ведут себя уникальным образом. Связывание, которое происходит в металле, отвечает за его отличительные свойства: блеск, пластичность, пластичность и отличную проводимость.
Металлическая связь
Чистые металлы представляют собой твердые кристаллические вещества, но в отличие от ионных соединений каждая точка кристаллической решетки занята одним и тем же атомом.Электроны на внешних энергетических уровнях металла подвижны и способны перемещаться от одного атома металла к другому. Это означает, что металл более правильно рассматривать как массив положительных ионов, окруженный морем подвижных валентных электронов. Электроны, которые могут свободно перемещаться по пустым орбиталям металлического кристалла, называются делокализованными электронами (см. рисунок ниже). Металлическая связь — это притяжение неподвижных катионов металла к окружающим мобильным электронам.
Рисунок 8.16
В металле неподвижные катионы металла окружены морем подвижных валентных электронов, которые не связаны ни с одним катионом.
Свойства металлов
Модель металлической связи объясняет физические свойства металлов. Металлы очень хорошо проводят электричество и тепло благодаря свободному течению электронов. Когда электроны входят в один конец куска металла, равное количество электронов выходит наружу из другого конца.Когда свет падает на поверхность металла, его электроны поглощают небольшое количество энергии и возбуждаются на одну из его многочисленных пустых орбиталей. Электроны немедленно падают на более низкие энергетические уровни и излучают свет. Этот процесс обеспечивает высокий блеск металлов.
Рисунок 8.17
Американский платиновый орел — официальная платиновая инвестиционная монета Соединенных Штатов, впервые отчеканенная в 1997 году. Блеск металла обусловлен металлическими связями.
Напомним, что ионные соединения очень хрупкие. Приложение силы приводит к тому, что одноименно заряженные ионы в кристалле подходят слишком близко друг к другу, что приводит к разрушению кристалла. Когда к металлу прикладывается сила, свободно текущие электроны могут проскользнуть между неподвижными катионами и предотвратить их соприкосновение. Представьте себе шарикоподшипники, покрытые маслом, скользящие друг по другу. В результате, металлы очень пластичны, и пластичны, .Из них можно придать форму, свернуть в тонкие листы или натянуть на тонкую проволоку.
Сводка
- Металлическая связка отвечает за свойства металлов.
- Металлы хорошо проводят электричество и тепло.
- Металлы пластичны и пластичны.
- Металлы имеют блеск.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: //www.chemguide.co.uk/atoms/bonding/metallic.html
- Что происходит с валентными электронами в металлах?
- Что удерживает вместе атомы металла?
- Что происходит с металлической связкой при плавлении металла?
- Что происходит с металлической связкой, когда металл закипает?
Обзор
Вопросы
- Что такое делокализованный электрон?
- Почему металлы хорошо проводят электричество и тепло?
- Почему металлы имеют блеск?
- делокализованных электронов: Электроны, которые способны свободно перемещаться по пустым орбиталям металлического кристалла.
- пластичный: Может быть вытянут в тонкую проволоку.
- lustre: Нежный блеск или мягкое свечение, особенно от частично отражающей поверхности.
- ковкий: Способен к постоянному деформированию или прессованию без разрушения и растрескивания.
- металлическая связь: Притяжение неподвижных катионов металлов к окружающим подвижным электронам.
— металл глянец
— металл глянецНатрий (та-металл, тан-металл) Натрий — исключительно редкий металл, обычно его получают из костей богов Небесной Воды или Огненной Воды, в первую очередь Таниана и его немногих потомков.Электроны, протоны, нейтроны или валентные электроны. 350 раз. Plutonium Metall. Количество: 10 г. (0,35 унции. Многие металлические минералы становятся тусклыми или землистыми, когда они подвергаются воздействию элементов в течение длительного времени (например, серебро, они тускнеют). Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. 0 1. Блеск, твердый, податливый и тусклый — все элементы атома, за исключением блеска. Блеск не следует путать с цветом: медно-желтый кристалл пирита имеет металлический блеск, как и блестящий серый кристалл галенита.БЕЖЕВЫЙ — Блеск для драгоценных металлов для нанесения надглазурной краски. Сульфидный минерал, любой член группы соединений серы с одним или несколькими металлами. Обычно они образуют кислые или нейтральные оксиды с кислородом, который, растворяясь в воде, реагирует с образованием кислот: \ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {углекислота}} {H_2CO_ { 3 (водн.)}} \], \ [CO_ {2 (г)} + 2NaOH _ {(водн.)} \ Rightarrow Na_2CO_ {3 (водн.)} + H_2O _ {(l)} \]. Большинство элементов, перечисленных в периодической таблице, — это металлы. Таким образом, металлы являются электроположительными элементами.Податливость. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно. Eisner886. Монацит представляет собой минерал от желтовато-коричневого до красновато-коричневого или зеленовато-коричневого цвета со смолистым или стекловидным блеском. Свойства являются промежуточными между металлами и неметаллами. Минералы с металлическим блеском выглядят как Металлы, такие как сталь или медь. Ковкость относится к свойству металлов, благодаря которому их можно расколоть на тонкие листы. Они обладают характеристиками блестящего и непрозрачного, даже если смотреть через тонкий край.Печатная плата использует свойство — хорошую проводимость электричества металлами. Платина зарекомендовала себя благодаря своей пластичности, плотности и неагрессивным свойствам. mrsbjtee. Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится. Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами. Он полупрозрачный и редко встречается в крупных зернах или хорошо сформированных кристаллах. На свету металлы имеют характерный блестящий вид.Zuhause. Металлы: Неметаллы: Хорошие проводники электричества и тепла. Бор — это универсальный элемент, который может быть включен в ряд соединений (см. Рисунок 2). Минералы с металлическим блеском выглядят как металл, например, серебристый или плоский кусок стали. Электроны в этих металлах притягивают кислород, углерод и другие вещества в воздухе, образуя слой тусклых соединений. Боросиликатное стекло чрезвычайно устойчиво к тепловым ударам. Все металлы требуют определенного ухода, особенно очистки, но некоторые требуют периодической замены и полировки.Химия. Стекловидный — этот блеск составляет примерно 70 процентов всех минералов. 11. Интересные факты о металлах Серебро проводит электричество лучше, чем любой другой металл. Известно, что металлы обладают свойством отражать свет от своей поверхности, поэтому это хороший материал для указанного продукта. Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Таким образом, годная кость натрия никогда не регистрировалась. Сохранить. В нормальных условиях металлы являются твердыми телами, за исключением ртути.Есть вопросы или комментарии? Например, один аллотроп олова больше похож на неметалл. В этой галерее представлены основные типы блеска, от металлического до матового. Блеск. Лантаноид Металл + Цер Металл. 2 Блеск, проводимость и пластичность — это физические свойства металлов. Это отражение является зеркальным, а не рассеянным, поэтому металлическая поверхность выглядит блестящей или блестящей. Два основных типа блеска — металлический и неметаллический. В периодической таблице Менделеева насчитывается около девяноста различных типов металлических или металлических элементов.Плохие проводники тепла и электричества. Они обладают характеристиками блестящего и непрозрачного, даже если смотреть через тонкий край. Какая группа элементов может иметь характеристики блестящих (блестящих) неметаллов, металлоидов, металлов, металлоидов / металлов. В чем разница между металлическим и неметаллическим блеском? Неметаллы могут быть газообразными, жидкими или твердыми. В целом, металлические обручальные кольца делятся на 5 основных цветовых категорий: желтый, белый, розовый, черный и серый. Свойства металлов В периодической таблице Менделеева насчитывается около девяноста различных типов металлов или металлических элементов.Тонкие осколки или участки субметаллических минералов полупрозрачны. https://chem.libretexts.org/@app/auth/3/login?returnto=https%3A%2F%2Fchem.libretexts.org%2FCourses%2FMount_Royal_University%2FChem_1201%2FUnit_2. в металлическом и неметаллическом характере, информацию свяжитесь с нами по адресу [email protected], на странице состояния на https://status.libretexts.org. Чтобы понять основные свойства, отделяющие металлы от нементалов и металлоидов, ионы переходных металлов не следуют очевидным образец, 2, Соединения металлов с неметаллами имеют тенденцию быть, Семь неметаллов существуют в стандартных условиях как.Металлы ПРОЕКТ. Обзор обновления драгоценных металлов: Обычно золото является самым сильным драгоценным металлом в периоды высокой волатильности, неопределенности и чрезмерной ликвидности. В. Металлы также непрозрачны и не пропускают свет. 8 ответов. Тестирование металлов и неметаллов Основная викторина! 1. Блеск: Металлы имеют блестящую поверхность. 350 раз. Когда электроны вибрируют, они излучают собственный свет. Металлоиды используются в полупроводниковой промышленности. Оксиды металлов обычно твердые при комнатной температуре. Платина.Lustre (британский английский) или lustre (американский английский; см. Различия в написании) — это способ взаимодействия света с поверхностью кристалла, камня или минерала. Слово восходит к латинскому lux, что означает «свет», и вообще подразумевает сияние, блеск или блеск. Для описания блеска используется ряд терминов, таких как землистый, металлический, жирный и шелковистый. G Физические свойства проявляются только после химического изменения. минералы имеют металлический блеск и считаются субметаллическими.Эта общая тенденция не обязательно наблюдается с переходными металлами. Металлы блестят, потому что они содержат свободные электроны, которые колеблются при контакте со светом. Металл наиболее блестящий, когда его сначала режут. Ответ 7 сентября 2014 г., 1:00 # 1. Редактировать. Их оксиды растворимы в кислотах и воде. Податливость. Скучный. Действительно ли сложность произнесения названия химического вещества соответствует тенденции: чем легче, тем менее вредно и тем… Например, минерал пирит, показанный на левой фотографии, в основном имеет блестящий металлический блеск.Блеск; Способность хорошо отражать свет. Легко забивается или раскатывается в листы. Можно втягивать в провода. Проводники; Они хорошо передают тепло и электричество. Ионное соединение; Когда соединяются металлы и неметаллы. Металлическое соединение; Когда положительно заряженные ионы металла окружены… Непрозрачным, как тонкий лист. Изделие, для которого требуется высокий блеск металлов, — это зеркало. 9 класс. Блеск относится к тому, как свет отражается от поверхности минерала. Формула: — серебро (Ag) Цвет: — серебристо-белый, тускнеет до черного.Актуальные вопросы. Металлический глянец. Это отражается назад и создает блестящий, блестящий вид металла. Металл, любой из класса веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света. Это электроотрицательные элементы. Большинство сульфидов имеют простую структуру, проявляют высокую симметрию в своих кристаллических формах и обладают многими свойствами металлов, включая металлический блеск и электропроводность.Таким образом, металлы являются электроположительными элементами с относительно низкой энергией ионизации. Контрольная работа . Разницу между металлическими и неметаллическими минералами можно четко провести по следующим причинам: Металлические минералы можно понимать как минералы, в которых металлы присутствуют в их первоначальной форме. Свет, падающий на зеркало, отражался бы и формировал изображение за зеркалом. Блеск, также пишется как блеск, это простое слово, обозначающее сложную вещь: способ взаимодействия света с поверхностью минерала.Что происходит с атомной структурой, которая делает каплю чистого металла или сплава характерным металлическим блеском? 6. Люстер. Похож ли он вообще на другие виды блеска, встречающиеся в природе, такие как перья синей сойки или шеллак? 1. Al имеет заряд 3+, оксид-ион — O2-, то есть Al2O3. Керамические люстры представляют собой органические соединения драгоценных металлов и недрагоценных металлов, предлагаемые в виде готовой краски, которая ..… CINNAMON ORANGE — Блеск для драгоценных металлов для нанесения надглазурной краски. \ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \].Остались вопросы? Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Листы металла толщиной более нескольких микрометров кажутся непрозрачными, но сусальное золото пропускает зеленый свет. В каких автомобилях самые дорогие каталитические нейтрализаторы? Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой: Al2O3 (s) + 6HNO3 (aq) -> 2Al (NO3) 3 (aq) + 3h3O (l). Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество.Übergangsmetalle-Kupfer Metall. Они проводят тепло и электричество, имеют металлический блеск и имеют тенденцию быть плотными, пластичными и пластичными. Принято считать, что это… Во-вторых, чем отличается металлический блеск от неметаллического? Актиноид Металл + Калифорний Металл. Небольшой тест:… Чистое золото слишком мягкое для многих вещей, поэтому большая часть золота сочетается с другими металлами, чтобы сделать его прочнее. Металлы блестящие и блестящие, по крайней мере, когда они только что приготовлены, отполированы или сломаны. Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами).Ученые переопределили блеск как описание способа взаимодействия света с поверхностью кристалла, камня или минерала. Kalzium Metall. Блеск используется для описания чего-то, что отражает свет от поверхности. Металлы не имеют блеска, они хрупкие и не проводят электричество. Blei Metall. Beitrag Transition Metals + Wismut Metall. Щелкните, чтобы увидеть полный ответ. Внешний вид — Цвет и блеск металла зависит от ваших личных предпочтений. Можно ли красить алкидную краску поверх латексной краски? Он блестит, как металл, но хрупок, как неметалл.Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. Многие украшения сделаны из 18-каратного золота, которое на 75% состоит из золота и 25% из других металлов. Электроны, протоны, нейтроны или валентные электроны. Податливые и пластичные (гибкие) как твердые тела. Субметаллический — описывает минерал, который является непрозрачным или почти непрозрачным и хорошо отражает. Минералы с металлическим блеском непрозрачны для света даже на тонких краях. Протоны. Этот красивый блеск делает золото идеальным металлом для изготовления ювелирных изделий.Блеск на металлической поверхности — это металлический блеск. Элементы, которые имеют от 1 до 3 валентных электронов, являются металлами. Зильбер Металл. Физические свойства относятся к элементам, а не соединениям. Однако некоторые из этих элементов обладают неметаллическими характеристиками. Обычно твердые при комнатной температуре, некоторые из них являются магнитными Неметаллы Неметаллический блеск (тусклый). Хрупкие, если твердые тела Непроводники тепла и электричества, НО являются хорошими изоляторами. Свойство металлов, которое в чистом виде обычно светится.Редактировать. Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Задайте вопрос + 100. Металлы также непрозрачны, не пропускают свет. Редактировать . Ковкость относится к свойству металлов, благодаря которому их можно измельчать на тонкие листы. Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению по мере того, как мы перемещаемся вправо в любой период (неметаллический характер усиливается с увеличением значений ионизации).Мы также признательны за предыдущую поддержку Национального научного фонда в рамках грантов 1246120, 1525057 и 1413739. За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Редактировать. Элемент — это вещество, состоящее из атомов одного типа: например, элемент гелий (то же вещество, что и воздушные шары) состоит исключительно из атомов гелия. Похожие темы. В чем разница между Koolaburra от UGG и UGG? Таким образом, металлы являются электроположительными элементами.Металлический блеск предназначен для непрозрачных и отражающих минералов, которые выглядят как полированный металл. Его блестящий, привлекательный жемчужный блеск, а также способность измельчаться в крошечные плоские хлопья делают его идеальной добавкой в самые разные продукты. Alibaba предлагает 486 поставщиков глянцевых металлов и производителей, дистрибьюторов, фабрик и компаний глянцевых металлов. Сегодня большая часть золота в мире производится в ювелирных изделиях. Свободные электроны могут свободно перемещаться в металле, заставляя падающий на них свет отражаться обратно.Металлы / металлы. Химия. Приняли LibreTexts для своего класса? Для получения дополнительной информации свяжитесь с нами по адресу [email protected] или посетите нашу страницу статуса по адресу https://status.libretexts.org. Сохранить. ) Температура обжига: 700-830 ° C (1300-1540 ° F) (до конуса Ортона SSB 014) Концентрация свинца .. 5,79 € + Warenkorb. Общие вопросы. Металлы обладают и другими свойствами, такими как хороший проводник тепла и электричества, звучность и т. Д., Которые используются в других продуктах. Мебель вашей спальни должна соответствовать? Получите ответы, задав вопрос прямо сейчас.Обзор обновления драгоценных металлов: Обычно золото является самым сильным драгоценным металлом в периоды высокой волатильности, неопределенности и чрезмерной ликвидности. 1. -хрупкий -высокий блеск -пластичный -пластичный -не очень реактивный 1, 2 и 5? Это гораздо более слабый проводник тепла и электричества, чем металлы. Это отражение является зеркальным, а не рассеянным, поэтому металлическая поверхность выглядит блестящей или блестящей. Переходный металл; Работа ; Химия; Кислород; Химическая реакция ; Больше викторин по металлу.Блеск на металлической поверхности — это металлический блеск. 23 Глянцевая проводимость и пластичность — физические свойства металлов. Что из MINE 629 в Университете Западной Вирджинии, автор eisner886. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). 1. Кремний широко используется в компьютерных микросхемах и другой электронике, поскольку его электрическая проводимость находится между проводимостью металла и неметалла. Нажмите, чтобы увидеть полный ответ. Что такое глянец в металле? Свободные электроны могут свободно перемещаться в металле, заставляя падающий на них свет отражаться обратно.Металлический блеск имеют и другие минералы. Существует несколько подтипов неметаллического блеска: стекловидный, смолистый, жемчужный, жирный, шелковистый, адамантиновый, матовый и восковой. Все металлы имеют блеск, потому что это то, что мы называем этим свойством, когда на них попадает свет, и то, что мы наблюдаем в них. Металлы имеют тенденцию быть мягкими, что означает, что из образца полосы металла может быть получено больше порошкообразного материала, чем из неметалла. Редактировать. Родий. B. Их физические свойства, как правило, металлические, но их химические свойства, как правило, неметаллические.Сыграли 350 раз. Металлы также известны своим уникальным внешним видом. Неметаллические элементы не имеют блеска. Эти элементы обычно имеют три основных свойства: что происходит с атомной структурой, которая делает каплю чистого металла или сплава характерным металлическим блеском? Ученые переопределили блеск как описание способа взаимодействия света с поверхностью кристалла, камня или минерала. Что из этого является свойством металлов? Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество.Металлы блестят из-за наличия в них свободных электронов. Что из этого является свойством металлов? Ложь. Copyright 2020 FindAnyAnswer Все права защищены. 0 0. Есть два вида отражения: диффузное отражение и зеркальное отражение. Нет света. Металлы блестят из-за наличия в них свободных электронов. Редактировать. eisner886. Средняя точность 77%. Нажмите здесь, чтобы дать нам знать! Минералы с металлическим блеском выглядят как металлы, такие как сталь или медь. Блеск. Сохранить. Блеск — это то, что мы воспринимаем, когда фотон ударяется о материал, который в основном состоит из элементов, на оболочке которых находится от 1 до 3 электронов.Яркий полет. Сохранить. Металлический блеск — это блеск незапятнанной металлической поверхности, такой как золото, сталь, медь, галенит, пирит и гематит. Соединения, полностью состоящие из неметаллов, являются молекулярными веществами (не ионными). Металлы / металлы. Какое из следующих утверждений о щелочных металлах верно? Эрбий Металл. Определение металлического блеска — это блеск, характерный для металлов в компактном состоянии, который проявляется также другими веществами (как минерал или краситель). Некоторые общие примеры — различные пириты, которые используются для изготовления монет, золотых самородков и меди.Актуальные вопросы. Иногда встречаются зернистые массы там, где местами много монацита. Металлы ПРОЕКТ. Блеск: блеск минерала — это общий блеск его поверхности — он может иметь блеск полированного металла или неполированного металла, покрытого ямками в результате выветривания, — или он может иметь блеск стекла, или выглядеть тусклым или землистым и т. Д. .Использование и другие свойства:… Они электроотрицательны по своему характеру. Отличительный блеск (блеск) Бесцветный, различных цветов: Податливые и пластичные (гибкие), как твердые тела: Хрупкие, твердые или мягкие: Проводят тепло и электричество: Плохие проводники: Оксиды металлов являются основными, ионные: Оксиды неметаллов являются кислотными, соединения: Катионы в водном растворе: Анионы, оксианионы в водном растворе: Металлы.Металлик — минералы с металлическим блеском непрозрачны и отражают, как металл. Химия. Этот чрезвычайно редкий, ценный металл серебристого цвета обычно используется из-за его отражающих свойств. Есть два вида отражения: диффузное отражение и зеркальное отражение. Электроны в соединениях не так свободно перемещаются, как в чистом металле. Редактировать . Примерно три четверти всех известных химических элементов — это металлы. Средняя точность 77%. Китай переходит на импортную медь в черновой и катодной форме, в то время как лом теряет блеск в 2020 году [ИСПРАВЛЕНО] Китай увеличил импорт рафинированной и нерафинированной меди более чем на 31% в годовом исчислении в 2020 году, в то время как приток лома значительно сократился, что отражает изменение политики импорта в отношении поступающих отходов вступает в силу в конце года.Подведение итогов. Существует два основных типа блеска: металлический и неметаллический. Свойство металлов, которое в чистом виде обычно светится. Узнайте больше о металлах в этой статье. Металлы могут быть очень блестящими, как хром на вашей машине… 9-го класса. Поэтому минералы, которые обладают металлическим блеском, имеют тенденцию демонстрировать толстую, плотную, темную полосу, тогда как минералы, обладающие неметаллическим блеском, имеют тенденцию давать более тонкую, менее плотную полосу, которая также имеет более светлый цвет. В нормальных условиях металлы являются твердыми телами, за исключением ртути.Что придает металлам их блеск? Многие металлические минералы становятся тусклыми или землистыми при длительном воздействии элементов (например, серебро, они тускнеют). Латунь — это сплав цинка и меди. 1. 1. Умирает ли Гермиона в «Гарри Поттере и проклятом ребенке»? Протоны. К другим свойствам относятся: Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Основные металлы обладают характеристиками, которые люди обычно ассоциируют с термином «металл». Erdalkalimetalle + Beryllium Metall.Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. Ответ 7 сентября 2014 г., 1:00 # 1. Физические свойства металлов 6-8 классов. Что из этого является свойством металлов? Сохранить. Несокрушимый. Suche nach allen Produkten, Herstellern und Händlern von Lüster: Preislisten, Kataloge und Neuheiten Lustre, то, как минерал отражает свет, — это первое, что нужно наблюдать в минерале. Алюминий Металл. Хрупкий — если твердый. Редактировать.Вопросы по металлургии! Практикуйте викторину MCQ по металлам и неметаллам! Базовая викторина по металлам и неметаллам! 0 1. минералы имеют металлический блеск и считаются субметаллическими. Блеск: блеск минерала — это общий блеск его поверхности — он может иметь блеск полированного металла или неполированного металла, покрытого ямками в результате выветривания, — или он может иметь блеск стекла, или выглядеть тусклым или землистым и т. Д. Их порошки используются при изготовлении металлических красок. Щелочные металлы имеют оболочки с полной валентностью. Щелочные металлы образуют 1-катионы. Щелочные металлы очень реакционноспособны. Щелочные металлы образуют 2-катионы. Пожалуйста, помогите.Многие металлы имеют высокий уровень блеска … См. Полный ответ ниже. Похож ли он вообще на другие виды блеска, встречающиеся в природе, такие как перья синей сойки или шеллак? Обслуживание — Обслуживание связано с долговечностью. Перламутровый блеск: минералы, такие как барит (фотография слева), имеют блеск, похожий на блеск внутри моллюска… Блеск: кремний, например, кажется блестящим, но не податливым или пластичным (он хрупкий — характеристика некоторых неметаллов). Гадолиний Металл. 5 лет назад . Юридический. Помните, что металлы бывают разных цветов, например, золото, серебро, медь, латунь, железо и алюминий.Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. Элементы далее подразделяются на металлы, неметаллы и металлоиды. Выберите все, что подходит. Таким образом, большая часть падающего света немедленно переизлучается на поверхности, создавая металлический цвет, состояние или качество сияния за счет отражения света; блеск, блеск, блеск или блеск: the. Не обладают металлическим блеском. 9564 раза. Определение металлического блеска: блеск, характерный для металлов в компактном состоянии, проявляемый также другими веществами (как минерал или краситель). Источник (и): https: // shortte.im / a9FxG. Торий Металл. Коррозия: Металлы склонны окисляться на воздухе и подвергаться коррозии. Кристаллическая система: — кубическая. 2 года назад. химия. Он ломается от хорошего до отчетливого. 3 года назад. Свойства металлов. Скучный. Что такое металлический блеск? A. Золото, серебро и медь имеют металлический блеск. 2 года назад. Металлы ПРОЕКТ. Найдите поставщиков высококачественных блестящих металлов на… Вопрос: Мохамед Гембе | Последнее обновление: 14 марта 2020 г., традиционное определение сосредоточено на объемных свойствах, энергия передается по остальной части, электроны, которые способны свободно перемещаться по пустым орбиталям, поверхность металла может поглотить все длины волн падающего света, и возбужденные электроны перескакивают на более высокий свободный уровень энергии.Что отличает эти свойства от химических свойств? Податливый — можно разбивать на тонкие листы. Анонимный. Что из этого является свойством металлов? Следовательно, такие металлы, как золото, серебро, платина и медь, широко используются в украшениях. Обладают металлическим блеском. Что придает металлам их блеск? Математика нерастворима: металлы не растворяются в воде или любых других растворителях. Средняя точность 77%. Элементы могут быть классифицированы как металлы или неметаллы в зависимости от их свойств. Какие 3 типа блеска? Как очистить ванну с помощью уксуса и средства для мытья посуды? Правда.Высокий блеск металлов для полировки важен, так как функция зеркала — отражать свет. Если не указано иное, содержимое LibreTexts лицензировано CC BY-NC-SA 3.0. Атомный номер элемента — это полное количество каких частиц в ядре? Некоторые чистые металлы, такие как свинец, имеют высокий блеск при первоначальной резке или полировке, но со временем они приобретают тусклый вид. Твердое или жидкое состояние металлов в значительной степени обусловлено способностью атомов металлов участвовать в… химии.Другие химические свойства включают: Какова химическая формула оксида алюминия? Мусковитовая слюда — еще один минерал, который используется в коммерческих целях из-за его блеска. Присоединиться. Металл (от греческого μέταλλον métallon, «шахта, карьер, металл») — это материал, который при свежеприготовленной обработке, полировке или трещине имеет блестящий вид и относительно хорошо проводит электричество и тепло.
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в периодической таблице — металлы.
Металлы находятся в центре и в левой части таблицы Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок по науке о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части.Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапинах или полировке.
- Ковкость: Металлы прочные, но пластичные, а это значит, что их можно легко согнуть или придать им форму.На протяжении веков кузнецы могли формировать металлические предметы, нагревая металл и ударяя по нему молотком. Если бы они попробовали это с неметаллами, материал бы лопнул! Большинство металлов также пластичные , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы отлично проводят электричество и тепло. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода. Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, являются твердыми при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы подвергаются химическому изменению (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Калий и натрий являются наиболее химически активными металлами. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не вступают в реакцию с другими металлами.Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки.
Пять групп металлов:
Благородные металлы обнаруживаются как чистые металлы, потому что они не вступают в реакцию и не соединяются с другими элементами с образованием соединений. Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реактивны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было разрезать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы находятся в соединениях с множеством различных минералов. Они менее химически активны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах.Они твердые и блестящие, прочные и легко поддаются форме. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Плохие металлы довольно мягкие, и большинство из них мало используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Сплавы: сильные комбинации
Свойства этих разных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко формуются и красивы.Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что при изготовлении ювелирных изделий оно всегда смешивается с другим металлом (обычно серебром, медью или цинком).Чистота золота измеряется в карат . Самое чистое, что вы можете получить в ювелирных изделиях, — это 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, которое популярно в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — это горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов очистки железа от руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода с помощью сильфонов. Углерод и кислород, включая кислород в руде, соединяются и покидают железо. Однако железо не нагревается до полного расплавления и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать из кованого железа .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции происходит отделение железа от кислорода в руде. Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании с помощью углерода и других элементов он становится более прочным металлом, называемым сталью .
Учитывая этот процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а легированная бронза, как полагают, была открыта шумерами около 3500 г. до н.э. Но алюминий, один из важнейших металлов в современном мире, не был открыт до 1825 года нашей эры и не использовался широко до 20 века!
Коррозия: процесс и предотвращение
Вы когда-нибудь видели кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже с дырами в результате коррозии? Это происходит, когда кислород (обычно из воздуха) вступает в реакцию с металлом.Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому виду химического разрушения или коррозии .
Когда кислород вступает в реакцию с металлом, он образует оксид на поверхности металла. Для некоторых металлов, например алюминия, это хорошо. Оксид образует защитный слой, предохраняющий металл от дальнейшей коррозии.
Чугун и сталь, с другой стороны, имеют серьезные проблемы, если их не обрабатывать для предотвращения коррозии.Красноватый оксидный слой, который образуется на железе или стали при реакции с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая большую часть металла коррозии, пока металл в конечном итоге не проедает.
Один из распространенных способов защиты железа — это покрытие его специальной краской, которая препятствует взаимодействию кислорода с металлом под краской. Другой метод — цинкование : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе вступают в реакцию с цинком, образуя слой карбоната цинка, который защищает от коррозии.Посмотрите вокруг своего дома, двора и гаража, чтобы найти примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Технологии: фейерверки и химия
Если вы посмотрите фейерверк Четвертого июля, то увидите прекрасные сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ — химия. Более длинный включает в себя обзор свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (взрывающихся в небе) является черный порошок , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порошок смешивают с металлическими порошками и другими химическими соединениями в форме, которая будет гореть медленно, сверху вниз. В простых ракетах-фейерверках черный порох заключен в трубку вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета — трубы с черным порохом, которая при зажигании вызывает реакцию взрыва. Затем воспламенитель фейерверк-снаряда загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда заставляет его заряды со специальными эффектами взорваться.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шарах, называемых звезд , сделанных из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если горит соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: лампы накаливания и люминесценции. Накаливание — это свет, возникающий при нагревании: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Компаунды с меньшей реакционной способностью не нагреваются до такой степени, что искры становятся тусклее. Люминесценция , с другой стороны, возникает из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они возвращаются на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам светящийся зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Дополнительная литература по металлам:
. - Металлический блеск

 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления. Они имеют электроотрицательный характер.
Они имеют электроотрицательный характер.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.

 {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
 Эти электроны не принадлежат ни одному атому – они обобществлены. Для лучшего понимания представьте себе «электронный газ». Такая система из положительных ионов, связанных обобществлёнными электронами, называется металлической связью.
Эти электроны не принадлежат ни одному атому – они обобществлены. Для лучшего понимания представьте себе «электронный газ». Такая система из положительных ионов, связанных обобществлёнными электронами, называется металлической связью. 0}
0} После приложения даже небольшой разницы потенциалов эти электроны начинают перемещаться от отрицательного полюса к положительному, образуя электрический ток.
После приложения даже небольшой разницы потенциалов эти электроны начинают перемещаться от отрицательного полюса к положительному, образуя электрический ток. 3% нашего тела приходится на металлы, но не волнуйтесь: детекторы в аэропорту на них не сработают! Люди используют более 1,5 миллиарда тонн металла ежегодно. Мы пользуемся металлами каждый день. Благодаря их замечательным свойствам, металлы необходимы и абсолютно незаменимы в нашей жизни.
3% нашего тела приходится на металлы, но не волнуйтесь: детекторы в аэропорту на них не сработают! Люди используют более 1,5 миллиарда тонн металла ежегодно. Мы пользуемся металлами каждый день. Благодаря их замечательным свойствам, металлы необходимы и абсолютно незаменимы в нашей жизни. metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий.
metallum — шахта) — один из классов элементов, которые, в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 80 %). Самым распространенным металлом в земной коре является алюминий.
 Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
 Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
 В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
В основном это инструментальные стали и твердые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
 По положению ртутного столбика мы определяем температуру тела. Чем выше температура тела, тем сильнее расширяется ртуть и, следовательно, выше поднимается ртутный столбик. Самый твёрдый – хром — режет стекло. Самые мягкие- калий, рубидий, цезий- легко режутся ножом.
По положению ртутного столбика мы определяем температуру тела. Чем выше температура тела, тем сильнее расширяется ртуть и, следовательно, выше поднимается ртутный столбик. Самый твёрдый – хром — режет стекло. Самые мягкие- калий, рубидий, цезий- легко режутся ножом.


 Золотые кольца и серьги будут блестеть сильнее, если подержать их в солёной воде.
Золотые кольца и серьги будут блестеть сильнее, если подержать их в солёной воде. Её тоже делают из алюминия. Налей в кастрюлю воды, положи соды и тот серебряный предмет, который надо почистить . Прокипяти всё это. Предмет должен быть только из металла, серебра.
Её тоже делают из алюминия. Налей в кастрюлю воды, положи соды и тот серебряный предмет, который надо почистить . Прокипяти всё это. Предмет должен быть только из металла, серебра. И если на время поместить в такую воду семена, они быстрее прорастают, их всхожесть увеличивается. Срезанные цветы дольше стоят в «серебряной воде».
И если на время поместить в такую воду семена, они быстрее прорастают, их всхожесть увеличивается. Срезанные цветы дольше стоят в «серебряной воде».
 Запишите признаки, по которым можно различить пластины, изготовленные:
Запишите признаки, по которым можно различить пластины, изготовленные:

 Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите. 003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды: При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
